题目内容
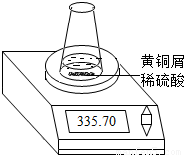
某学习小组的同学们用下图所示装置测定黄铜屑(锌铜合金)的组成,他们首先取一定量的黄铜屑放入锥形瓶中,并加入足量的稀硫酸.然后观察到不同时间电子天平的读数如下表所示(不考虑水逸出):
| 反应时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 烧杯及所盛 物质总质量/g | 335.70 | 335.54 | 335.44 | 335.38 | 335.34 | 335.32 | 335.31 | 335.30 | 335.30 |
(2)若要计算黄铜屑中锌的质量分数,还缺少的数据是______.
(3)若该数据用a表示,求出黄铜屑中锌的质量分数(写出计算过程).
解:(1)因为锌铜合金中的锌可以与稀硫酸反应生成氢气,结合表中所给数据可知,锥形瓶总质量的减少量即为氢气的生成量,即:反应生成氢气的总质量:335.70g-335.30g=0.4g
故答案为:0.4g;
(2)锌的质量分数= ×100%,而锌的质量可以通过释放氢气的质量求出,但缺少黄铜的质量;
×100%,而锌的质量可以通过释放氢气的质量求出,但缺少黄铜的质量;
故答案为:黄铜屑的质量;
(3)解设:锌的质量为x
Zn+H2SO4=ZnSO4+H2↑
65 2
x 0.4g
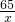 =
=
x=13g
锌的质量分数= ×100%=
×100%= ×100%
×100%
答:黄铜屑中锌的质量分数为 ×100%.
×100%.
分析:(1)根据锌铜合金中的锌可与稀硫酸的反应原理并结合题中所给表格分析即可;
(2)根据合金中锌的质量分数的计算方法分析即可;
(3)根据合金中锌的质量分数的计算方法即可作答.
点评:此题属于信息题,同学们要会从所给信息中提取有用信息,排除其它无关信息的干扰.
故答案为:0.4g;
(2)锌的质量分数=
 ×100%,而锌的质量可以通过释放氢气的质量求出,但缺少黄铜的质量;
×100%,而锌的质量可以通过释放氢气的质量求出,但缺少黄铜的质量;故答案为:黄铜屑的质量;
(3)解设:锌的质量为x
Zn+H2SO4=ZnSO4+H2↑
65 2
x 0.4g
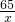 =
=
x=13g
锌的质量分数=
 ×100%=
×100%= ×100%
×100%答:黄铜屑中锌的质量分数为
 ×100%.
×100%.分析:(1)根据锌铜合金中的锌可与稀硫酸的反应原理并结合题中所给表格分析即可;
(2)根据合金中锌的质量分数的计算方法分析即可;
(3)根据合金中锌的质量分数的计算方法即可作答.
点评:此题属于信息题,同学们要会从所给信息中提取有用信息,排除其它无关信息的干扰.

练习册系列答案
相关题目
某学习小组的同学们用下图所示装置测定黄铜屑(锌铜合金)的组成,他们首先取一定量的黄铜屑放入锥形瓶中,并加入足量的稀硫酸.然后观察到不同时间电子天平的读数如下表所示(不考虑水逸出):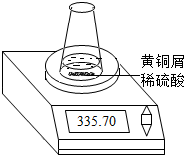
(1)反应生成氢气的总质量为 g.
(2)若要计算黄铜屑中锌的质量分数,还缺少的数据是 .
(3)若该数据用a表示,求出黄铜屑中锌的质量分数(写出计算过程).

| 反应时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 烧杯及所盛 物质总质量/g |
335.70 | 335.54 | 335.44 | 335.38 | 335.34 | 335.32 | 335.31 | 335.30 | 335.30 |
(2)若要计算黄铜屑中锌的质量分数,还缺少的数据是
(3)若该数据用a表示,求出黄铜屑中锌的质量分数(写出计算过程).
某学习小组的同学们用下图所示装置测定黄铜屑(锌铜合金)的组成,他们首先取一定量的黄铜屑放入锥形瓶中,并加入足量的稀硫酸.然后观察到不同时间电子天平的读数如下表所示(不考虑水逸出):
(1)反应生成氢气的总质量为______g.
(2)若要计算黄铜屑中锌的质量分数,还缺少的数据是______.
(3)若该数据用a表示,求出黄铜屑中锌的质量分数(写出计算过程).

| 反应时间/min | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | |
| 烧杯及所盛 物质总质量/g | 335.70 | 335.54 | 335.44 | 335.38 | 335.34 | 335.32 | 335.31 | 335.30 | 335.30 |
(2)若要计算黄铜屑中锌的质量分数,还缺少的数据是______.
(3)若该数据用a表示,求出黄铜屑中锌的质量分数(写出计算过程).

某学习小组的同学们用下图所示装置测定黄铜屑(锌铜合金)的组成,他们首先取一定量的黄铜屑放入锥形瓶中,并加入足量的稀硫酸.然后观察到不同时间电子天平的读数如下表所示(不考虑水逸出):
(1)反应生成氢气的总质量为______g.
(2)若要计算黄铜屑中锌的质量分数,还缺少的数据是______.
(3)若该数据用a表示,求出黄铜屑中锌的质量分数(写出计算过程).
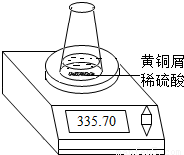
| 反应时间/min | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | |
| 烧杯及所盛 物质总质量/g | 335.70 | 335.54 | 335.44 | 335.38 | 335.34 | 335.32 | 335.31 | 335.30 | 335.30 |
(2)若要计算黄铜屑中锌的质量分数,还缺少的数据是______.
(3)若该数据用a表示,求出黄铜屑中锌的质量分数(写出计算过程).

某学习小组的同学们用下图所示装置测定黄铜屑(锌铜合金)的组成,他们首先取一定量的黄铜屑放入锥形瓶中,并加入足量的稀硫酸.然后观察到不同时间电子天平的读数如下表所示(不考虑水逸出):
(1)反应生成氢气的总质量为______g.
(2)若要计算黄铜屑中锌的质量分数,还缺少的数据是______.
(3)若该数据用a表示,求出黄铜屑中锌的质量分数(写出计算过程).
| 反应时间/min | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | |
| 烧杯及所盛 物质总质量/g | 335.70 | 335.54 | 335.44 | 335.38 | 335.34 | 335.32 | 335.31 | 335.30 | 335.30 |
(2)若要计算黄铜屑中锌的质量分数,还缺少的数据是______.
(3)若该数据用a表示,求出黄铜屑中锌的质量分数(写出计算过程).
