题目内容
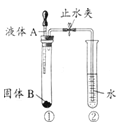
【题目】今有一混合物的水溶液,只可能含有以下离子中的若干种:Na+、NH4+、Ba2+、Cl-、CO![]() 、SO
、SO![]() 。现取两份200 mL溶液进行如下实验:①第一份加足量NaOH溶液,加热,有气体产生;②第二份加足量BaCl2溶液后,得干燥沉淀,经足量盐酸洗涤、干燥后,沉淀质量减轻。根据上述实验,以下推测正确的是 ( )
。现取两份200 mL溶液进行如下实验:①第一份加足量NaOH溶液,加热,有气体产生;②第二份加足量BaCl2溶液后,得干燥沉淀,经足量盐酸洗涤、干燥后,沉淀质量减轻。根据上述实验,以下推测正确的是 ( )
A.Na+ 一定存在 B.SO![]() 可能存在
可能存在
C.一定不存在Ba2+,NH4+可能存在 D.可能存在Cl-
【答案】D
【解析】
试题分析:最开始,待测物是水溶液,说明没有沉淀物,所以Ba2+和CO32-、SO42-是无法共存的.
首先,①操作中,加入OH-有气体生成,则肯定存在NH4+②中, 加足量BaCl2溶液后,得干燥沉淀,最后有不溶于稀盐酸的沉淀,,没有Ag+,这个沉淀肯定是BaSO4所以,Ba2+肯定存在.另外有能溶于稀盐酸的沉淀,那么就是CO32-,绝对没有Ba2+ 所以,得到两个结论,肯定有NH4+和CO32-、SO42-,肯定没有Ba2+
于是用排除法:A Na+可能存在,错误
B SO42-一定存在,错误
C Ba2+一定不存在, NH4+一定存在,错误
D Cl-可能存在,正确。

练习册系列答案
相关题目
【题目】石灰石是主要矿产品之一,某学校研究性学习小组为了测量当地矿石山石灰石中CaCO3的质量分数,取一些矿石样品,并取稀盐酸200克,平均分成4份,进行实验,结果如下:
实验 | 1 | 2 | 3 | 4 |
加样品的质量(克) | 5 | 10 | 15 | 20 |
生成CO2的质量(克) | 1.76 | 3.52 | 4.4 | m |
问:(1)哪几次反应中矿石有剩余?
(2)上表中m的数值是
(3)试计算这种石灰石中CaCO3的质量分数.