题目内容
【题目】金属材料是人类社会发展的见证者,人类文明的发展和社会的进步同金属材料关系十分密切。
(一)金属初探
(1)铜在空气中加热会逐渐变黑,写出该反应的化学方程式 。
(2)硬铝、不锈钢是常见的金属材料。它们属于 (选填“合金”或“纯金属”)。
(3)为了减少和避免雷电对高层建筑的危害,需安装由金属材料制成的避雷装置,这主要是利用了金属材料的 。(填序号)
A.密度大 B.导电性 C.导热性 D.熔点高
(二)一氧化碳还原氧化铁
【查阅资料】氢氧化钠溶液能吸收二氧化碳;
铁及铁的氧化物 | Fe | FeO | Fe2O3 | Fe3O4 |
颜色 | 黑色 | 黑色 | 红棕色 | 黑色 |
能否被磁铁吸引 | 能 | 不能 | 不能 | 能 |
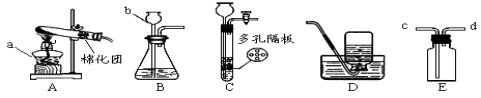
兴趣小组设计了如右图实验装置进行实验。

(1)实验前应先 。
(2)加热前应先通CO一会,其作用是 ,实验结束后,应先 。(选填“停止加热”
或“停止通CO”)
(1)将一定质量的氧化铁粉末放入玻璃管中,反应一段时间后,得到黑色固体粉末,并能全被磁铁吸引。兴趣小组猜想黑色粉末可能是
(1)铁粉;(2)四氧化三铁;(3)你的猜想是 。
实验证明黑色粉末全是四氧化三铁,请写出该变化的化学方程式 。
(4)为收集尾气并除去气体样品中的二氧化碳,下列装置最为合理的是 。(填序号)

(三)铜锈成分的确定
【查阅资料】
①铜锈的主要成分可以看成是aCu(OH)2bCuCO3。
②Cu(OH)2、CuCO3受热易分解,各生成对应的两种氧化物。
③Cu(OH)2的分解温度为66℃∽68℃,CuCO3的分解温度为200℃~220℃。
小组同学用热分析仪对aCu(OH)2bCuCO3固体进行热分解,获得相关数据,绘成固体质量变化与分解温度的关系如右图,请根据图示回答下列问题:

(1)写出A B、C D段发生反应的化学方程式:
AB段: ;
CD段: ;
(2)BC段固体为 ;
(3)通过计算可得: a:b= 。
(4)若将16.0g剩余固体继续加热到更高的温度,发现
程中可能发生反应的化学方程式: 。
【答案】(一)金属初探 (1)2Cu+ O2![]() 2CuO(2)合金(3)B
2CuO(2)合金(3)B
(二)一氧化碳还原氧化铁(1)应先检查装置的气密性(2)排尽装置内空气,避免爆炸(意思相近也给分),停止加热(3)Fe和Fe3O4的混合物、3Fe2O3+ CO ![]() 2Fe3O4 + CO2 (4)C
2Fe3O4 + CO2 (4)C
(三)铜锈成分的确定(1)Cu(OH)2 ![]() CuO + H2O CuCO3
CuO + H2O CuCO3 ![]() CuO + CO2 ↑
CuO + CO2 ↑
(2)CuO、CuCO3(3)1:1 (4)4CuO ![]() 2Cu2O + O2 ↑
2Cu2O + O2 ↑
【解析】
试题分析:(一)金属初探 (1)为铜被氧化的反应;(2)金属材料有纯金属和合金,硬铝、不锈钢符合合金的定义,为合金;(3)导电是利用导电性;
(二)一氧化碳还原氧化铁(1)有气体参与需应先检查装置的气密性(2)CO若与空气混合在高温条件下易发生爆炸,所以需先排尽空气;为避免产物Fe重新被空气中氧气氧化,需保证其在无空气条件下冷却,因此先停止加热至Fe冷却后再停止通入CO;(3)由控制变量的规律可知;略; 4.既要保证气体通过试液,又要保证CO不能排出,选C。
(三)铜锈成分的确定(1)Cu(OH)2的分解温度为66℃∽68℃因此AB段为Cu(OH)2的分解 ;CuCO3的分解温度为200℃~220℃ ,因此CD段为CuCO3的分解;(2)BC段Cu(OH)2已经分解为CuO,且CuCO3还未分解,因此有CuO、CuCO3;AB段减少质量为22.2g-20.4g=1.8g,结合Cu(OH)2 ![]() CuO + H2O ,可知m(H2O)=1.8g,设CuO质量为x,
CuO + H2O ,可知m(H2O)=1.8g,设CuO质量为x,
Cu(OH)2 ![]() CuO + H2O
CuO + H2O
98 18
x 1.8g
98/x=18/1.8g,x=9.8g;
同理可得CD段减少的质量为CO2的质量,结合CuCO3 ![]() CuO + CO2 ↑
CuO + CO2 ↑
可得碳酸铜的质量=12.g,因此a:b=9.8g/98:12.4g/124=1:1;
(4)剩余固体为CuO,由元素组成,质量再次减少只能是生成了氧气;且n(CuO):n(O2)=16.0g/80: 1.6g/32=4:1,再结合质量守恒定律推测另一产物为CuO,由此方程式为4CuO ![]() 2Cu2O + O2 ↑。
2Cu2O + O2 ↑。

 优学名师名题系列答案
优学名师名题系列答案