题目内容
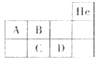
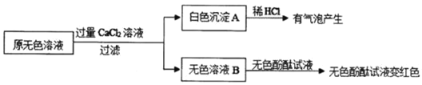
【题目】培养学生的科学探究能力是新课程改革的重要理念。实验室现有一瓶标签残缺并且瓶盖没有完全密封的无色溶液(如图),经试验员分析可知原瓶溶液中的溶质可能是NaCl、Na2OH、Na2CO3、NaHCO3中的一种。为确认其中的溶质,同学们进行了如下的探究活动。请你参与到其中去,回答有关问题。
(进行猜想)猜想I:该溶液的溶质是NaCl
猜想Ⅱ:该溶液的溶质是NaOH
猜想Ⅲ:该溶液的溶质是Na2CO3
猜想IV:该溶液的溶质是NaHCO3。
(查阅资料)常温下物质的相关信息如表:
物质 | NaC1 | NaOH | Na2CO3 | NaHCO3 |
常温下的溶解度/g | 36 | 109 | 21.5 | 9.6 |
常温下稀溶液的pH | 7 | 13 | 11 | 9 |
从物质的相关信息可知,该溶液的溶质不是_____,请说出理由_____。
(进行实验)
(1)测定溶液的pH大于7,该溶液的溶质不是_____。
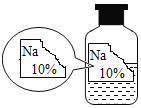
(2)同学们又进行了如下实验,实验过程如图:
①气泡生成的化学方程式是_____。
②实验可以判断原无色溶液中含有的溶质有_____。
(获得结论)
该瓶原来装的无色溶液的溶质是NaOH,并且_____(填“没有”、“部分”或“全部”)变质。
(拓展)
若提纯该无色溶液,写出有关反应原理(用化学方程式表示)_____。
【答案】碳酸氢钠 该饱和溶液溶质质量分数在该温度下不能达到10% NaCl ![]() NaOH、Na2CO3 部分
NaOH、Na2CO3 部分 ![]()
【解析】
[查阅资料]
根据计算可以知道在20℃时饱和碳酸氢钠的质量分数为:![]() ,所以能够排除碳酸氢钠;故填:碳酸氢钠;该饱和溶液溶质质量分数在该温度下不能达到10%;
,所以能够排除碳酸氢钠;故填:碳酸氢钠;该饱和溶液溶质质量分数在该温度下不能达到10%;
[进行实验]
(1)测定溶液的pH大于7,而氯化钠溶液呈中性pH等于7,所以不可能是氯化钠,故填:NaCl;
(2)①过量的氯化钙可以检验并除尽碳酸钠,碳酸钠可以和氯化钙反应生成碳酸钙沉淀和氯化钠,碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,反应的化学方程式为![]() ;
;
②滴加无色酚酞,滤液变红,说明溶液呈碱性,还有氢氧化钠,实验可以判断原无色溶液中含有的溶质有NaOH、Na2CO3;故填:NaOH、Na2CO3;
[获得结论]
该瓶原来装的无色溶液的溶质是NaOH,并且部分变质;故填:部分;
[拓展]
提纯该无色溶液的步骤是:先向无色溶液中加入适量的Ca(OH)2,然后过滤。反应化学方程式是![]() ;
;

【题目】固体铵盐A、B的成分可能是(NH4)2SO4、NH4HSO4,或是两者的混合物.甲、乙两个研究性学习小组要确定A和B的成分,并测定B中氮元素的质量分数.
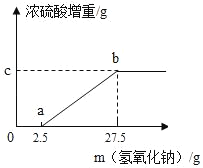
(1)甲实验小组的同学取了数份相同质量的样品A溶于水,然后加入40% NaOH溶液(图中用氢氧化钠质量表示),水浴加热至气体全部逸出(此温度下铵盐不分解).该气体经干燥后用足量浓硫酸完全吸收,浓硫酸增重的质量如图.分析该图象并回答下列问题:
①写出ab段涉及的化学方程式:_____.
②样品A的成分是_____,C点的数值是_____.
(2)乙实验小组的同学取了数份不同质量的样品B,测定方法与甲组同学大部分相同,不同的是,他们将不同质量的铵盐分别加入到50.00mL NaOH溶液中(含8.12g NaOH),测定结果如下:
实验编号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
铵盐的质量(g) | 10.00 | 20.00 | 30.00 | 50.00 |
浓硫酸增加的质量(g) | m | m | 1.36 | 0 |
①分析实验数据可知,实验编号为_____的实验中,氢氧化钠足量,铵盐中的铵根离子完全转化成气体.
②计算B中氮元素的质量分数.______(保留两位小数)