题目内容
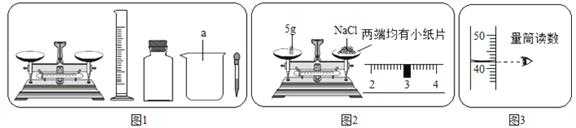
【题目】某同学设计了测定空气中氧气含量的实验,实验装置如图。该同学的实验步骤如下:
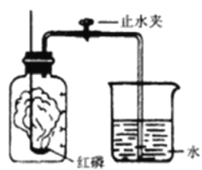
①将图中的集气瓶分为5等份,并作好标记。
②在带橡皮塞和导管的燃烧匙内装入足量的红磷,将导管上的止水夹夹紧,在酒精灯上点燃红磷,并立即伸入集气瓶内,塞紧橡皮塞。
③充分反应后,待集气瓶冷却至室温,打开止水夹。
请回答下列问题:
(1)该实验中红磷需稍过量,目的是__________________________________。
(2)步骤②集气瓶中的现象是_______________________________;步骤③中打开止水夹后观察到的现象是_________________________________ ,由此可得出氧气约占空气体积的__________。
(3)该实验可推论出氮气_________(填“易”或“难”)溶于水和其化学性质___________(填“活泼”或“不活泼”)的结论。
【答案】使集气瓶中的氧气完全反应剧烈燃烧,产生大量白烟,放热水进入集气瓶,进入的水约占集气瓶中空气体积的五分之一五分之一难不活泼
【解析】
根据实验测定空气中氧气含量的原理和实验现象进行分析解答。
(1)该实验中红磷与空气中的氧气反应生成五氧化二磷,红磷需稍过量,目的是使集气瓶中的氧气完全反应;
(2)步骤②中红磷在空气中燃烧,集气瓶中的现象是剧烈燃烧,产生大量白烟,放热;红磷燃烧消耗了空气中的氧气,瓶内的气压减小。步骤③中打开止水夹后观察到的现象是水进入集气瓶,进入的水约占集气瓶中空气体积的五分之一;由此可得出空气中氧气的体积分数约为五分之一;
(3)实验中,水进入集气瓶后,氮气没有减少,该实验可推论出氮气难溶于水,红磷在氮气中不能燃烧,说明氮气化学性质不活泼。

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目