题目内容
某制碱厂以岩盐水为主要原料生产纯碱(Na2CO3)和其他副产品.
(一)有关资料:
原料岩盐水主要是含NaCl,此外还含有较多Na2SO4,以及少量CaCl2和MgCl2.上述几种物质在不同温度时的溶解度数据如下表:
(1)10℃时,饱和Na2SO4溶液中溶质的质量分数是
(二)生产工艺

经上述处理后得到主产品:工业纯碱,副产品:A晶体.
(2)“降温”的目的是析出副产品“A晶体”,A的化学式是_
(3)“操作I”名称是 _
(4)“盐水精制Ⅱ”是除去盐水中的其他杂质.反应的化学方程式是:
(三)工业纯碱中杂质的判断:已知:NH4Cl
NH3↑+HCl↑
实验步骤:
①取一定质量的纯碱样品,经多次充分加热后再称重,发现质量无变化;
②另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀.
(5)由上述实验可确定纯碱样品含有杂质
(一)有关资料:
原料岩盐水主要是含NaCl,此外还含有较多Na2SO4,以及少量CaCl2和MgCl2.上述几种物质在不同温度时的溶解度数据如下表:
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | |
| 溶 解 度 /g |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 |
| Na2SO4 | 4.5 | 9.6 | 20.2 | 40.8 | 48.4 | |
| CaCl2 | 59.5 | 65.0 | 74.5 | 100 | 116 | |
| MgCl2 | 52.9 | 53.8 | 54.8 | 56.0 | 58.0 | |
8.8%
8.8%
(精确到0.1%).(二)生产工艺

经上述处理后得到主产品:工业纯碱,副产品:A晶体.
(2)“降温”的目的是析出副产品“A晶体”,A的化学式是_
Na2SO4
Na2SO4
;(3)“操作I”名称是 _
过滤
过滤
(4)“盐水精制Ⅱ”是除去盐水中的其他杂质.反应的化学方程式是:
Na2CO3+Ca(OH)2=2NaOH+CaCO3↓
Na2CO3+Ca(OH)2=2NaOH+CaCO3↓
、CaCl2+Na2CO3═CaCO3↓+2NaCl
CaCl2+Na2CO3═CaCO3↓+2NaCl
(三)工业纯碱中杂质的判断:已知:NH4Cl
| ||
实验步骤:
①取一定质量的纯碱样品,经多次充分加热后再称重,发现质量无变化;
②另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀.
(5)由上述实验可确定纯碱样品含有杂质
NaCl
NaCl
(写化学式)分析:(1)根据固体的溶解度表可以:查出某种物质在一定温度下的溶解度,从而可以计算出在一定量的溶剂中最多溶解的溶质的质量及形成的饱和溶液中溶质的质量分数;
(2)根据固体的溶解度曲线可以判断出物质的溶解度随温度变化的变化情况,从而确定通过降温还是蒸发溶剂的方法使溶质从溶液中结晶析出.
(3)分离固液混合物用过滤的操作.
(4)根据钙离子的性质分析,加入碳酸钠溶液可以和钙离子反应生成碳酸钙沉淀而除去钙离子.书写方程式关键要根据书写要求进行解答.
(5)根据纯碱样品含有的杂质,可用反向思维方法,先确定白色沉淀,再推断杂质是什么进行分析.
(2)根据固体的溶解度曲线可以判断出物质的溶解度随温度变化的变化情况,从而确定通过降温还是蒸发溶剂的方法使溶质从溶液中结晶析出.
(3)分离固液混合物用过滤的操作.
(4)根据钙离子的性质分析,加入碳酸钠溶液可以和钙离子反应生成碳酸钙沉淀而除去钙离子.书写方程式关键要根据书写要求进行解答.
(5)根据纯碱样品含有的杂质,可用反向思维方法,先确定白色沉淀,再推断杂质是什么进行分析.
解答:解:(1)由于在10℃时,硫酸钠的溶解度是9.6g,即在100克水中最多溶解9.6g硫酸钠,形成的饱和溶液中溶质的质量分数为:
×100%=8.8%,故答案为:8.8%
(2)由于岩盐水主要含氯化钠,此外还含有较多硫酸钠,以及少量氯化钙和氯化镁,而且氯化钠的溶解度受温度的影响很小,而硫酸钠的溶解度随温度的降低明显减小,因此降温时析出的主要是Na2SO4,故答案为:Na2SO4;
(3)由于是把析出的晶体和溶液分开,因此应用过滤的方法,故答案为:过滤;
(4)经过盐水精致I的处理,盐水精致II中有氯化钙和过量的氢氧化钙,它们都能与碳酸钠反应,反应的化学方程式为:Na2CO3+Ca(OH)2=2NaOH+CaCO3↓;
CaCl2+Na2CO3═CaCO3↓+2NaCl;
(5)由题意可知,滴加AgNO3溶液,有白色沉淀,此沉淀即AgCl,所以反应物中一定有氯离子,由题意可知,向该溶液中加入过量稀HNO3反应物,并且样品完全溶于水,由此可以推断纯碱样品含有杂质NaCl,故答案为:NaCl;
故答案为:(1)8.8%;(2)Na2SO4;(3)过滤;(4)Na2CO3+Ca(OH)2=2NaOH+CaCO3↓;CaCl2+Na2CO3═CaCO3↓+2NaCl;(5)NaCl;
| 9.6g |
| 9.6g+100g |
(2)由于岩盐水主要含氯化钠,此外还含有较多硫酸钠,以及少量氯化钙和氯化镁,而且氯化钠的溶解度受温度的影响很小,而硫酸钠的溶解度随温度的降低明显减小,因此降温时析出的主要是Na2SO4,故答案为:Na2SO4;
(3)由于是把析出的晶体和溶液分开,因此应用过滤的方法,故答案为:过滤;
(4)经过盐水精致I的处理,盐水精致II中有氯化钙和过量的氢氧化钙,它们都能与碳酸钠反应,反应的化学方程式为:Na2CO3+Ca(OH)2=2NaOH+CaCO3↓;
CaCl2+Na2CO3═CaCO3↓+2NaCl;
(5)由题意可知,滴加AgNO3溶液,有白色沉淀,此沉淀即AgCl,所以反应物中一定有氯离子,由题意可知,向该溶液中加入过量稀HNO3反应物,并且样品完全溶于水,由此可以推断纯碱样品含有杂质NaCl,故答案为:NaCl;
故答案为:(1)8.8%;(2)Na2SO4;(3)过滤;(4)Na2CO3+Ca(OH)2=2NaOH+CaCO3↓;CaCl2+Na2CO3═CaCO3↓+2NaCl;(5)NaCl;
点评:本题难度较大,主要考查了物质的分离操作和除去杂质的方法,要根据物质的性质选择适当的方法进行解答,书写化学方程式时一定要规范.培养学生对知识的应用和理解的能力.

练习册系列答案
相关题目
 某制碱厂以岩盐水为主要原料生产纯碱(碳酸钠)和其他副产品.
某制碱厂以岩盐水为主要原料生产纯碱(碳酸钠)和其他副产品.(一)原料岩盐水主要含氯化钠,此外还含有较多硫酸钠,以及少量氯化钙和氯化镁.上述几种物质在不同温度时的溶解度数据如下表:
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | |
| 溶 | 氯化钠 | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 |
| 解 | 硫酸钠 | 4.5 | 9.6 | 20.2 | 40.8 | 48.4 |
| 度 | 氯化钙 | 59.5 | 65.0 | 74.5 | 100 | 116 |
| /g | 氯化镁 | 52.9 | 53.8 | 54.8 | 56.0 | 58.0 |
(二)岩盐水初步处理后,经净化、精制得到生产碳酸钠所需要的食盐水,同时制取副产品A晶体,其主要流程如下:
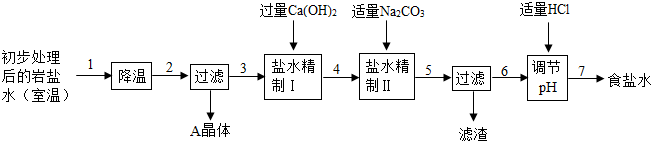
(1)“降温”的目的是析出副产品“A晶体”,它是
(2)“盐水精制I”中发生反应的化学方程式是
(3)“盐水精制Ⅱ中发生反应的化学方程式是
(4)经过上述精制过程中,仍有一种物质并没有能够完全除去,该物质可以在溶液精制过程中步骤
(三)用上述精制后的食盐水为原料生产的纯碱产品中会含有少量氯化钠杂质.该制碱厂的
产品包装袋上注明:碳酸钠含量≥96%.为测定该产品中含碳酸钠的质量分数,进行了以下实验:取18.0g纯碱样晶放入烧杯中,称得烧杯及所盛纯碱样品的总质量为158.Og,再把lOOg稀盐酸平均分成四份依次加入样品中,每次均充分反应.实验数据记录如下:
| 所加盐酸的次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 盐酸的质量 | 25 | 25 | 25 | 25 |
| 烧杯及所盛物质总质量 | 180.3 | 202.6 | 226.4 | 251.4 |
(1)第一次加入稀盐酸充分反应后,生成二氧化碳的质量是
(2)该产品中碳酸钠的质量分数是否合格?(要求写出计算过程,结果精确到0.1%)
某制碱厂以岩盐水为主要原料生产纯碱(碳酸钠)和其他副产品.
(一)原料岩盐水主要含氯化钠,此外还含有较多硫酸钠,以及少量氯化钙和氯化镁.上述几种物质在不同温度时的溶解度数据如下表:
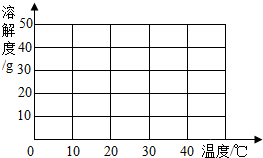
(1)根据所提供的溶解度数据,画出硫酸钠的溶解度曲线.
(2)10℃时由100g水配制得到的饱和硫酸钠溶液中溶质的质量是 g,溶质的质量分数是 (精确到0.1%).
(二)岩盐水初步处理后,经净化、精制得到生产碳酸钠所需要的食盐水,同时制取副产品A晶体,其主要流程如下: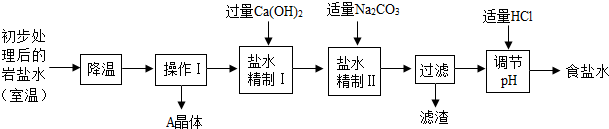
(3)“降温”的目的是析出副产品“A晶体”,A的化学式是 .
(4)“操作I”中的操作是 ,若在实验室进行该操作,需要用到的玻璃仪器除烧杯、玻璃棒外,还有 .
(5)“盐水精制I”是除去盐水中的少量氯化镁,反应的化学方程式是 .
(6)“盐水精制Ⅱ”是除去盐水中的其他杂质,反应的化学方程式是 .
(一)原料岩盐水主要含氯化钠,此外还含有较多硫酸钠,以及少量氯化钙和氯化镁.上述几种物质在不同温度时的溶解度数据如下表:
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | |
| 溶解度/g | 氯化钠 | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 |
| 硫酸钠 | 4.5 | 9.6 | 20.2 | 40.8 | 48.4 | |
| 氯化钙 | 59.5 | 65.0 | 74.5 | 100 | 116 | |
| 氯化镁 | 52.9 | 53.8 | 54.8 | 56.0 | 58.0 | |
(2)10℃时由100g水配制得到的饱和硫酸钠溶液中溶质的质量是
(二)岩盐水初步处理后,经净化、精制得到生产碳酸钠所需要的食盐水,同时制取副产品A晶体,其主要流程如下:

(3)“降温”的目的是析出副产品“A晶体”,A的化学式是
(4)“操作I”中的操作是
(5)“盐水精制I”是除去盐水中的少量氯化镁,反应的化学方程式是
(6)“盐水精制Ⅱ”是除去盐水中的其他杂质,反应的化学方程式是

 某制碱厂以岩盐水为主要原料生产纯碱(Na2CO3)和其他副产品.
某制碱厂以岩盐水为主要原料生产纯碱(Na2CO3)和其他副产品.