题目内容
【题目】盐城悦达汽车以其优良的性价比得到了越来越多消费者的喜爱.
(1)汽车电路中导线是金属铜,是利用了铜的_____性.
(2)汽车外壳主要是钢,钢的硬度_____纯铁,钢的熔点_____纯铁(填“>”“<”“=”).
(3)关于乙醇汽油的下列说法中不正确的是_____(填序号).
A使用乙醇汽油可减少大气污染 B乙醇可以用粮食发酵而成
C使用乙醇汽油可以明显减少温室效应 D使用乙醇汽油可节省石油资源
(4)全世界每年因生锈损失的钢铁,约占世界年产量的四分之一。
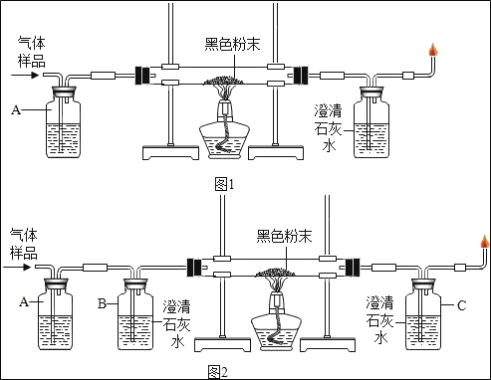
某学生想探究铁生锈是否必须同时有空气和水,他将干净的铁钉放入A、B、C三支干净的试管中,再各加入某些物质或用品进行研究。
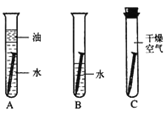
①一周后,编号为_____的试管中铁钉明显生锈,说明铁与_____和_____反应生成了铁锈。
②比较吐鲁番盆地和海南岛两地,铁生锈相对较慢的地区是_____,理由是_____。
(5)现有银、铜、铁三种金属,某研究小组的同学为探究银、铜、铁的金属活动性顺序,设计了三个实验:
Ⅰ.将铁片浸入稀硫酸中;Ⅱ.将银片浸入稀硫酸中;Ⅲ.将铁片浸入硫酸铜溶液中。
①实验Ⅰ的现象是:有气泡产生,溶液由无色逐渐变为浅绿色。反应的化学方程式为_____;反应产生的气体可用_____的方法检验。
②上述三个实验还不能完全证明三种金属的活动性顺序,请你补充一个实验来达到实验目的(写出实验操作和现象):_____。
根据以上探究,三种金属的活动性由强到弱的顺序是_____。
③将银、铁两种金属分别放入_____溶液中,即可验证这三种金属的活动性强弱。
(6)100吨含氧化铁80%的赤铁矿可炼得含杂质4%的生铁多少吨?_____
【答案】导电 > < C B 水 氧气 吐鲁番盆地 吐鲁番盆地气候比较干燥 Fe+H2SO4═FeSO4+H2↑ 燃着的木条燃烧 将铜丝进入硝酸银的溶液中,铜的表面有银白色固体析出,溶液由无色变为蓝色 铁、铜、银 硫酸铜 58.3t
【解析】
(1)金属铜作导线,故利用了铜的导电性;
(2) 钢是铁的合金,它的硬度比纯铁大,熔点比纯铁小,故填:>、<
(3)A、使用乙醇汽油可减少大气污染,故不符合题意;
B、乙醇可以用粮食发酵而成, 故不符合题意;
C、乙醇燃烧生成二氧化碳,二氧化碳导致温室效应,故不可以明显减少温室效应,符合题意;
D、使用乙醇汽油可节省石油资源, 故不符合题意;
(4)由图可知,编号为B的试管中的铁钉与水和氧气都接触,铁钉生锈快,说明铁与水和氧气反应生成了铁锈,故填写:B;水;氧气;
吐鲁番盆地气候干燥,水的含量很低,温度也低,铁制品不容易生锈;海南岛气候湿润,水的含量很高,温度较高,铁制品容易生锈.
故填:吐鲁番盆地;吐鲁番盆地气候比较干燥;
(5) 实验Ⅰ的反应物是铁和硫酸,生成物是硫酸亚铁和氢气,氢气后面标上上升符号;氢气能够燃烧并发出蓝色火焰,所以用燃着的木条进行检验即可;将铁片浸入稀硫酸中能产生氢气,说明铁排在氢的前面,将银片浸入稀硫酸中,不反应说明银排在氢的后面,将铁片浸入硫酸铜溶液中铁的表面有红色固体析出,说明铁比铜活泼,但铜和银不能比较,所以将铜丝进入硝酸银的溶液中,铜的表面有银白色固体析出,溶液由无色变为蓝色,说明铜比银活泼;金属与盐反应说明金属排在盐中金属的前面,金属与盐不反应,说明金属排在了盐中金属的后面,所以加入的盐溶液应该位于两种金属之间,由于铜在中间,所以两种金属放到硫酸铜溶液中即可; 故答案为:Fe+H2SO4═FeSO4+H2↑;燃着的木条燃烧;将铜丝进入硝酸银的溶液中,铜的表面有银白色固体析出,溶液由无色变为蓝色;铁、铜、银;硫酸铜
(6)解:设可炼得含杂质4%的生铁质量为x

![]()
x≈58.3t
答:可炼得含杂质4%的生铁质量为58.3t.

 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案【题目】《天工开物》中记载的“倭铅”即是金属锌,说明我国炼锌在明代就出现。
探究一 用锌制取氢气甲同学拟用如图实验装置完成制取氢气和测量生成气体体积实验:
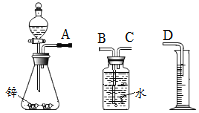
(1)写出锌与稀硫酸反应的化学方程式____。
(2)装置连接顺序是:A→___ →___→D(填字母)。
探究二 硫酸铜对氢气生成速率的影响
乙同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率,为此展开探究。
(设计实验)
在锥形瓶中分别放入足量的、等质量的、颗粒大小相同的锌粒,再向分液漏斗中加入由31.5%的稀硫酸,不同体积水、5%的硫酸铜溶液组成的混合液,试剂用量记录如下表:
混合液(试管编号) | ① | ② | ③ | ④ | ⑤ |
31.5%的H2SO4溶液/mL | 10 | V1 | 10 | 10 | 10 |
5%的CuSO4溶液/mL | 3.6 | 3.8 | 4.0 | 4.2 | 4.4 |
蒸馏水/mL | 16.4 | 16.2 | 16.0 | 15.8 | V2 |
收集70mL水所用时间/s | 21.20 | 20.45 | 19.69 | 20.49 | 21.33 |
(3)表中的V1=____mL,V2=____mL。
(分析与结论)
(4)表中____组反应速率最快,原混合液中H2SO4
探究三 锌与硫酸铜溶液反应
丙同学取打磨过的锌片按下表内容进行对比实验:
实验 项目 | 硫酸铜溶液 溶质质量分数 | 是否 添加稀硫酸 | 锌表面产生的现象 |
① | 1.6% | 否 | 黑色物质 |
② | 1.6% | 加2滴 | 红色物质,有极少量的气泡 |
③ | 8% | 否 | 红褐色物质 |
④ | 8% | 加2滴 | 光亮红色物质,有少量的气泡 |
⑤ | 16% | 否 | 红色物质,有极少量的气泡 |
⑥ | 16% | 加2滴 | 光亮红色物质,有较多气泡 |
(分析与结论)
(5)锌与硫酸铜溶液反应要产生红色的物质,需要的条件是___。
(6)根据第⑤组实验判断,硫酸铜溶液可能显___(选填:“酸”、“碱”或“ 中”)性。