题目内容
24、某兴趣小组的同学在实验室用含有少量生石灰的氯化钠固体配制一定质量分数的氯化钠溶液.实验步骤如下图所示: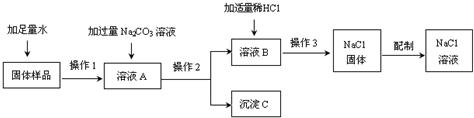
请回答:
(1)在“固体样品”中加入水时所发生反应的化学方程式为
(2)“溶液A”中所含溶质为
(3)在“操作2”中,要用到的玻璃仪器除玻璃棒、烧杯外,还有
(4)加入“适量稀HCl”的目的是
(5)“沉淀C”是
(6)“操作3”的名称是
(7)①用提纯的NaCl配制200g 0.9%的生理盐水,需要NaCl的质量为
②用托盘天平称量所需的氯化钠时,发现托盘天平的指针偏向左盘,应
A.增加适量砝码 B.减少适量氯化钠固体 C.调节平衡螺母
③在用量筒量取所需水的过程中,若俯视读数,而其余操作均正确,这样配得的溶液的溶质质量分数会

请回答:
(1)在“固体样品”中加入水时所发生反应的化学方程式为
CaO+H2O═Ca(OH)2
.(2)“溶液A”中所含溶质为
Ca(OH)2和NaCl
(填化学式).(3)在“操作2”中,要用到的玻璃仪器除玻璃棒、烧杯外,还有
漏斗
.(4)加入“适量稀HCl”的目的是
除去溶液中的氢氧化钠、碳酸钠
.(5)“沉淀C”是
CaCO3
(填化学式).(6)“操作3”的名称是
蒸发
.(7)①用提纯的NaCl配制200g 0.9%的生理盐水,需要NaCl的质量为
1.8
g.②用托盘天平称量所需的氯化钠时,发现托盘天平的指针偏向左盘,应
B
.A.增加适量砝码 B.减少适量氯化钠固体 C.调节平衡螺母
③在用量筒量取所需水的过程中,若俯视读数,而其余操作均正确,这样配得的溶液的溶质质量分数会
偏高
(填“偏高”、“偏低”、或“无影响”).分析:(1)根据氧化钙会与水反应进行分析;
(2)根据样品的成分和发生的反应进行分析;
(3)根据进行操作2需要的仪器进行分析;
(4)根据A中反应后的成分进行分析;
(5)根据A中的反应和操作2进行分析;
(6)根据氯化钠的溶解度受温度的影响进行分析;
(7)①根据溶质质量的解法进行分析;
②根据天平的使用规则进行分析;
③根据正确使用量筒读书的方法进行分析.
(2)根据样品的成分和发生的反应进行分析;
(3)根据进行操作2需要的仪器进行分析;
(4)根据A中反应后的成分进行分析;
(5)根据A中的反应和操作2进行分析;
(6)根据氯化钠的溶解度受温度的影响进行分析;
(7)①根据溶质质量的解法进行分析;
②根据天平的使用规则进行分析;
③根据正确使用量筒读书的方法进行分析.
解答:解:(1)样品中的氧化钙和水反应生成氢氧化钙,故答案为:CaO+H2O═Ca(OH)2
(2)样品中的氧化钙和水反应生成了氢氧化钙,故答案为:Ca(OH)2和NaCl;
(3)要将不溶性的固体分离,需要进行过滤操作,过滤需要的玻璃仪器有:烧杯、漏斗、玻璃棒,故答案为:漏斗;
(4)加入碳酸钠后,和氢氧化钙反应生成了碳酸钙沉淀和氢氧化钠,所以溶液B中存在反应剩余的碳酸钠和生成的氢氧化钠,但是两者对于氯化钠都是杂质,故答案为:除去溶液中的氢氧化钠、碳酸钠;
(5)碳酸钠和氢氧化钙反应生成氢氧化钠和碳酸钙沉淀,过滤后,将碳酸钙滤出,故答案为:CaCO3;
(6)氯化钠的溶解度受温度影响变化较小,要得到氯化钠晶体需要蒸发溶剂,故答案为:蒸发;
(7)①溶质质量=溶液质量×溶质质量分数=200×0.9%=1.8g,故答案为:1.8;
②A、固体质量是一定的,不能增加砝码,故A错误;
B、向左偏,说明固体多,需要减少固体,故B正确;
C、称量过程中不能调平衡螺母,故C错误;故答案为:B;
③在使用量筒读数时,视线要与凹液面的最低处保持水平,故答案为:偏高.
(2)样品中的氧化钙和水反应生成了氢氧化钙,故答案为:Ca(OH)2和NaCl;
(3)要将不溶性的固体分离,需要进行过滤操作,过滤需要的玻璃仪器有:烧杯、漏斗、玻璃棒,故答案为:漏斗;
(4)加入碳酸钠后,和氢氧化钙反应生成了碳酸钙沉淀和氢氧化钠,所以溶液B中存在反应剩余的碳酸钠和生成的氢氧化钠,但是两者对于氯化钠都是杂质,故答案为:除去溶液中的氢氧化钠、碳酸钠;
(5)碳酸钠和氢氧化钙反应生成氢氧化钠和碳酸钙沉淀,过滤后,将碳酸钙滤出,故答案为:CaCO3;
(6)氯化钠的溶解度受温度影响变化较小,要得到氯化钠晶体需要蒸发溶剂,故答案为:蒸发;
(7)①溶质质量=溶液质量×溶质质量分数=200×0.9%=1.8g,故答案为:1.8;
②A、固体质量是一定的,不能增加砝码,故A错误;
B、向左偏,说明固体多,需要减少固体,故B正确;
C、称量过程中不能调平衡螺母,故C错误;故答案为:B;
③在使用量筒读数时,视线要与凹液面的最低处保持水平,故答案为:偏高.
点评:在解此类题时,首先分析题中考查的问题,然后结合具体的反应流程和学过的知识进行分析解答.

练习册系列答案
相关题目
某校兴趣小组的同学在综合实践活动中,从水泥厂拿来一块石灰石样品,技术员告诉他们此样品中含有的杂质是二氧化硅,二氧化硅难溶于水,不能与盐酸反应.为了测定该石灰石的纯度,兴趣小组的同学取用8.00g这种石灰石样品,用实验室现有的未知溶质质量分数的稀盐酸100克分5次加入,充分反应后,经过滤、干燥等操作后称量,得到如下数据:
试回答下列问题:
(l)表中m的值为 g.
(2)该石灰石样品的纯度.
(3)所用的稀盐酸中溶质的质量分数.
(4)第2次实验后所得溶液的溶质的质量分数.
| 实 验 次 数 | 1 | 2 | 3 | 4 | 5 |
| 加入稀盐酸的质量/g | 20.0 | 20.0 | 20.0 | 20.0 | 20.0 |
| 剩余固体的质量/g | 6.00 | m | 2.00 | 1.20 | 1.20 |
(l)表中m的值为
(2)该石灰石样品的纯度.
(3)所用的稀盐酸中溶质的质量分数.
(4)第2次实验后所得溶液的溶质的质量分数.
某校兴趣小组的同学在综合实践活动中,从水泥厂拿来一块石灰石样品,技术员告诉他们此样品中含有的杂质是二氧化硅,二氧化硅难溶于水,不能与盐酸反应。为了测定该石灰石的纯度,兴趣小组的同学取用8.00g这种石灰石样品,用实验室现有的未知溶质质量分数的稀盐酸100克分5次加入,充分反应后,经过滤、干燥等操作后称量,得到如下数据:
| 实 验 次 数 | 1 | 2 | 3 | 4 | 5 |
| 加入稀盐酸的质量/g | 20.0 | 20.0 | 20.0 | 20.0 | 20.0 |
| 剩余固体的质量/g | 6.00 | m | 2.00 | 1.20 | 1.20 |
试回答下列问题:
(l)表中m的值为_________g.
(2)该石灰石样品的纯度。
(3)所用的稀盐酸中溶质的质量分数。
(4)第2次实验后所得溶液的溶质的质量分数。
某校兴趣小组的同学在综合实践活动中,从水泥厂拿来一块石灰石样品,技术员告诉他们此样品中含有的杂质是二氧化硅,二氧化硅难溶于水,不能与盐酸反应.为了测定该石灰石的纯度,兴趣小组的同学取用8.00g这种石灰石样品,用实验室现有的未知溶质质量分数的稀盐酸100克分5次加入,充分反应后,经过滤、干燥等操作后称量,得到如下数据:
试回答下列问题:
(l)表中m的值为______g.
(2)该石灰石样品的纯度.
(3)所用的稀盐酸中溶质的质量分数.
(4)第2次实验后所得溶液的溶质的质量分数.
| 实 验 次 数 | 1 | 2 | 3 | 4 | 5 |
| 加入稀盐酸的质量/g | 20.0 | 20.0 | 20.0 | 20.0 | 20.0 |
| 剩余固体的质量/g | 6.00 | m | 2.00 | 1.20 | 1.20 |
(l)表中m的值为______g.
(2)该石灰石样品的纯度.
(3)所用的稀盐酸中溶质的质量分数.
(4)第2次实验后所得溶液的溶质的质量分数.
某校兴趣小组的同学在综合实践活动中,从水泥厂拿来一块石灰石样品,技术员告诉他们此样品中含有的杂质是二氧化硅,二氧化硅难溶于水,不能与盐酸反应.为了测定该石灰石的纯度,兴趣小组的同学取用8.00g这种石灰石样品,用实验室现有的未知溶质质量分数的稀盐酸100克分5次加入,充分反应后,经过滤、干燥等操作后称量,得到如下数据:
试回答下列问题:
(l)表中m的值为______g.
(2)该石灰石样品的纯度.
(3)所用的稀盐酸中溶质的质量分数.
(4)第2次实验后所得溶液的溶质的质量分数.
| 实 验 次 数 | 1 | 2 | 3 | 4 | 5 |
| 加入稀盐酸的质量/g | 20.0 | 20.0 | 20.0 | 20.0 | 20.0 |
| 剩余固体的质量/g | 6.00 | m | 2.00 | 1.20 | 1.20 |
(l)表中m的值为______g.
(2)该石灰石样品的纯度.
(3)所用的稀盐酸中溶质的质量分数.
(4)第2次实验后所得溶液的溶质的质量分数.
某校兴趣小组的同学在综合实践活动中,从水泥厂拿来一块石灰石样品,技术员告诉他们此样品中含有的杂质是二氧化硅,二氧化硅难溶于水,不能与盐酸反应.为了测定该石灰石的纯度,兴趣小组的同学取用8.00g这种石灰石样品,用实验室现有的未知溶质质量分数的稀盐酸100克分5次加入,充分反应后,经过滤、干燥等操作后称量,得到如下数据:
试回答下列问题:
(l)表中m的值为______g.
(2)该石灰石样品的纯度.
(3)所用的稀盐酸中溶质的质量分数.
(4)第2次实验后所得溶液的溶质的质量分数.
| 实 验 次 数 | 1 | 2 | 3 | 4 | 5 |
| 加入稀盐酸的质量/g | 20.0 | 20.0 | 20.0 | 20.0 | 20.0 |
| 剩余固体的质量/g | 6.00 | m | 2.00 | 1.20 | 1.20 |
(l)表中m的值为______g.
(2)该石灰石样品的纯度.
(3)所用的稀盐酸中溶质的质量分数.
(4)第2次实验后所得溶液的溶质的质量分数.