题目内容
1926年,我国著名化学家侯德邦先生创立了侯氏制碱法,促进了世界制碱技术的发展,以从海水中提取出来的食盐为主要原料制取纯碱.其生产过程中有下列反应:①NaCl+NH3+CO2+H2O═NaHCO3+NH4Cl;②2NaHCO3 Na2CO3+H2O+CO2↑;
Na2CO3+H2O+CO2↑;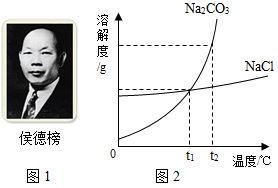
试回答下列问题:
(1)在反应①的六种物质中,焙制糕点是时常用作发酵粉的是 ;
(2)胺盐水比食盐水更容易吸收二氧化碳的原因是 .
(3)氯化钠和碳酸钠的溶解度如图2,t2℃时,氯化钠饱和溶液溶质的质量分数 碳酸钠饱和溶液溶质的质量分数
(填“大于”“小于”“等于”之一).
(4)生活在盐碱湖附近的人们有一句谚语“夏天晒盐,冬天捞碱”,请结合溶解度曲线,说明这句谚语的原理: .
(1)碳酸氢钠 (2)氨气溶于水呈碱性,更容易吸收酸性氧化物二氧化碳
(3)小于
(4)氯化钠的溶解度随湿度变化不大,由于夏天气温高,水分蒸发快,氯化钠易结晶斩出;纯碱的溶解度随温度的变化大,冬天气温很低,使碳酸钠结晶析出.
解析试题分析:(1)碳酸氢钠在焙制糕点时常用作发酵粉,故答案为:碳酸氢钠;
(2)氨气溶于水呈碱性,更容易吸收酸性氧化物二氧化碳,故答案为:氨气溶于水呈碱性,更容易吸收酸性氧化物二氧化碳;
(3)t2℃时,氯化钠的溶解度小于碳酸钠的溶解度,根据饱和溶液溶质质量分数= ×100%可知,t2℃时,氯化钠的饱和溶液中溶质的质量分数小于碳酸钠的饱和溶液中溶质的质量分数,故答案为:小于;
×100%可知,t2℃时,氯化钠的饱和溶液中溶质的质量分数小于碳酸钠的饱和溶液中溶质的质量分数,故答案为:小于;
(4)氯化钠的溶解度随湿度变化不大,由于夏天气温高,水分蒸发快,氯化钠易结晶斩出;纯碱的溶解度随温度的变化大,冬天气温很低,使碳酸钠结晶析出,故答案为:氯化钠的溶解度随湿度变化不大,由于夏天气温高,水分蒸发快,氯化钠易结晶斩出;纯碱的溶解度随温度的变化大,冬天气温很低,使碳酸钠结晶析出.
考点:纯碱的制取;结晶的原理、方法及其应用;固体溶解度曲线及其作用;溶质的质量分数、溶解性和溶解度的关系;常用盐的用途.
点评:本题难度不是很大,主要考查了碳酸氢钠的用途、饱和溶液中溶解度的计算以及根据固体的溶解度曲线解决相关的问题等,培养分析问题、解决问题的能力.

 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案下图是a、b、c三种物质的溶解度曲线a与c的溶解度曲线相交于P点。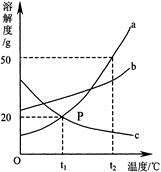
(1)P点的含义是 。
(2)t2℃时30g a物质加入到50g水中不断搅拌,能形成80g溶液吗? (填写“能”或“不能”)。
(3) t2℃时a、b、c三种物质的溶解度按由小到大的顺序排列是 (填写物质序号)。
(4)将t1℃时a、b、c三种物质饱和溶液的温度升高到t2℃时,三种溶液的溶质质量分数大小关系是 (填写选项序号)。
| A.c>a=b | B.a=b>c | C.a>b>c | D.b>a>c |
饮料中的果味大多来自酯类丁酸乙酯(C6H12O2)是无色具有菠萝香味的液体,常用作食品、 饮料的调香剂。下列叙述中,正确的是
| A.丁酸乙酯是由20个原子构成的 |
| B.丁酸乙酯的相对分子质量为116g |
| C.丁酸乙酯中碳、氢、氧元素的质量比为18:3:8 |
| D.一个丁酸乙酯分子中碳、氢、氧原子的个数比为3:6:2 |