题目内容
【题目】某同学在课外阅读中得知:实验室用电石(主要成分CaC2)与水反应制取乙炔(C2H2)反应的方程式为CaC2+2H2O=Ca(OH)2+C2H2↑。在实验室中该同学把一定量的CaC2加入Na2CO3溶液中,充分反应后过滤,得到滤渣和滤液,并对滤液的成分进行探究。
(提出问题)滤液中溶质的成分是什么?
(猜想与假设)猜想一:NaOH
猜想二:NaOH,Ca(OH)2
猜想三:NaOH,Na2CO3
(设计并实验)
实验 | 实验操作 | 实验现象 | 实验结论 |
实验一 | 取少量滤液于试管中,向试管中滴入适量的碳酸钠溶液 | _______ | 猜想二不成立 |
实验二 | 另取少量滤液于试管中,向其中加入过量稀盐酸 | 产生气泡 | 猜想___成立 |
写出实验二中产生气泡的化学方程式:________________
(拓展延伸)
①若向Cu(NO3)2溶液中加少量CaC2,充分反应,产生的现象是______________。
②实验室保存电石应注意______。
【答案】无明显现象三Na2CO3+2HCl=2NaCl+H2O+CO2↑;有气泡产生,出现蓝色沉淀;密封保存.
【解析】
(1)假设溶液中含有氢氧化钙,加入碳酸钠溶液后,会产生白色沉淀,要想让猜想二不成立,则滤液中不能含有Ca(OH)2,因此,向滤液中加入碳酸钠溶液后没有明显现象;向滤液中加入过量稀盐酸后有气泡产生,说明溶液中一定含有Na2CO3,所以,猜想三成立,该反应的方程式为:![]() 。
。
(2)电石与水反应生成乙炔和氢氧化钙,氢氧化钙再与硝酸铜反应得到氢氧化铜蓝色沉淀和硝酸钙,所以,反应现象为有气泡产生,出现蓝色沉淀;因为电石与水发生反应,因此需要密封保存。

【题目】将一定量的氢氧化钠和氯化铵固体混合物加热,测得反应前后各物质的质量如下表.
物质 | NaOH | NH4Cl | NaCl | H2O | X |
反应前质量/g | 8.0 | 10.7 | 0 | 0 | 0 |
反应后质量/g | 0 | 0 | 11.7 | 3.6 | a |
①表中a的值为2.8②X不一定是化合物③X中一定含有氢元素④X可能是该反应的催化剂⑤X的相对分子质量为17⑥X中一定含氢、氮元素,其质量比为2:7⑦X中氮元素的质量分数约为82.4%,对以上说法判断正确的是( )
A. ①②③正确 B. 只有⑤⑦正确 C. 只有⑥③正确 D. 只有①⑦正确
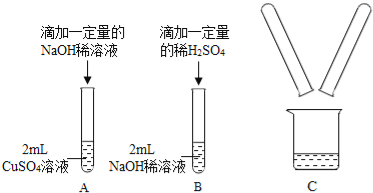
【题目】某化学兴趣小组在实验室做了如图所示的A、B两个实验.
(1)B实验中发生反应的化学方程式为 .
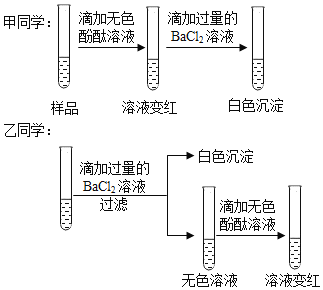
(2)A、B两个实验结束后,小明同学将两支试管中的物质同时加入一纯净的烧杯中(如图C所示),混合后,观察到烧杯中有蓝色沉淀.同学们将烧杯内的物质过滤,对所得滤液中溶质的成分进行探究.
(猜想)
小明猜想:滤液中的溶质是Na2SO4、CuSO4;
小光猜想:滤液中的溶质是Na2SO4、NaOH;
小英猜想:滤液中的溶质是Na2SO4、CuSO4、H2SO4;
你的猜想:滤液中的溶质还可能是 .
(讨论)你认为 的猜想一定不合理.如果滤液为无色,还可排除 的猜想,理由是 .
(实验)若小光的猜想正确,请完成下表的方案.
实验步骤 | 预想的实验现象 | 实验结论 |
取少量滤液与试管中,滴入 | | 小光的猜想正确 |