题目内容
【题目】某化学兴趣小组的同学发现,上个月做实验用的NaOH溶液忘记了盖瓶盖。对于该溶液是否变质,甲、乙两同学分别进行了如下实验探究:
(提出问题)该溶液是否变质,溶液中溶质是什么y
(猜想假设)猜想1:该溶液没有变质,溶液中溶质只有NaOH
猜想2:该溶液部分变质,溶液中溶质有NaOH和Na2CO3
猜想3:该溶液全部变质,溶液中溶质只有Na2CO3
查阅资料:Na2CO3溶液显碱性,能使无色酚酞溶液变红,而BaCl2溶液显中性。
(实验设计)
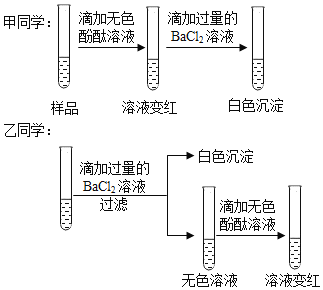
(实验结论)
(1)由甲、乙两同学的实验,可推知猜想1一定不正确,该溶液已_____(选填“部分”或“全部”)变质。
(2)写出乙同学实验中生成白色沉淀的化学方程式_____。
(评价反思)
(3)_____同学(选填“甲”或“乙”)不能得出正确的实验结论,其理由是_____。
【答案】部分Na2CO3+BaCl2=BaCO3↓+2NaCl甲;Na2CO3溶液呈碱性,也能使酚酞溶液变红色,无法证明是否含有NaOH
【解析】
(1)向样品中滴加氯化钡溶液时生成白色的碳酸钡沉淀,说明氢氧化钠变质生成的碳酸钠与之反应生成碳酸钡白色沉淀,过滤出反应后的溶液,滴加酚酞溶液,溶液变红色,说明原溶液中一定有氢氧化钠,因此该氢氧化钠溶液部分变质;
(2)乙同学实验中生成白色沉淀的反应是碳酸钠与氯化钡反应生成碳酸钡白色沉淀和氯化钠,反应的化学方程式为:Na2CO3+BaCl2=BaCO3↓+2NaCl;
(3)甲同学的第一步实验滴加无色酚酞无法得出溶液中是否含氢氧化钠,因为碳酸钠溶液也呈碱性。

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案【题目】某同学在课外阅读中得知:实验室用电石(主要成分CaC2)与水反应制取乙炔(C2H2)反应的方程式为CaC2+2H2O=Ca(OH)2+C2H2↑。在实验室中该同学把一定量的CaC2加入Na2CO3溶液中,充分反应后过滤,得到滤渣和滤液,并对滤液的成分进行探究。
(提出问题)滤液中溶质的成分是什么?
(猜想与假设)猜想一:NaOH
猜想二:NaOH,Ca(OH)2
猜想三:NaOH,Na2CO3
(设计并实验)
实验 | 实验操作 | 实验现象 | 实验结论 |
实验一 | 取少量滤液于试管中,向试管中滴入适量的碳酸钠溶液 | _______ | 猜想二不成立 |
实验二 | 另取少量滤液于试管中,向其中加入过量稀盐酸 | 产生气泡 | 猜想___成立 |
写出实验二中产生气泡的化学方程式:________________
(拓展延伸)
①若向Cu(NO3)2溶液中加少量CaC2,充分反应,产生的现象是______________。
②实验室保存电石应注意______。