��Ŀ����
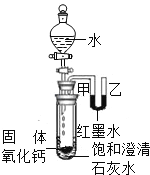
����Ŀ����ͼ��ʵ������ȡ�������弰������������ʵ�װ��ͼ����ͼ�ش���������:
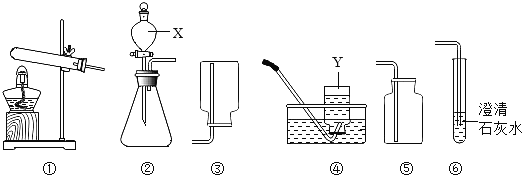
��1��д��װ�âں͢�������x��Y������:X______,Y_________
��2���ù���������Һ��������̹�������ȡ����ʱ,��Ҫѡ�õķ���װ����______(װ�ñ��),������Ӧ�Ļ�ѧ����ʽΪ_________.
��3��������ֻ̼����װ�â��ռ�,˵��������̼���е�����������_______,��װ�â��������̼ʱ������Ӧ�Ļ�ѧ����ʽΪ_________.
���𰸡���Һ©�� ����ƿ �� 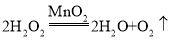 ������̼�ܶȱȿ���������ˮ
������̼�ܶȱȿ���������ˮ ![]()
��������
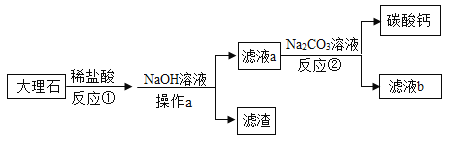
���������ڶ������̵Ĵ������·ֽ�����ˮ��������������̼���������Ʒ�Ӧ����̼��Ƴ�����ˮ��
��1��X�Ƿ�Һ©����Y�Ǽ���ƿ��
��2�����������ڶ������̵Ĵ������·ֽ�����ˮ��������ʵ�����ù���������ȡ�����ķ�Ӧ����Һ�壬��Ӧ�����dz��¡�����������Ҫѡ�õķ���װ���Ǣڣ���Ӧ�Ļ�ѧ����ʽΪ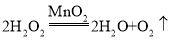 ��
��
��3��װ�â��ռ�����ķ����������ſ�������˵��������̼���е����������Ƕ�����̼�ܶȱȿ���������ˮ��������̼���������Ʒ�Ӧ����̼��Ƴ�����ˮ����Ӧ�Ļ�ѧ����ʽΪ![]() ��
��

 Сѧ��10���ӿ������100��ϵ�д�
Сѧ��10���ӿ������100��ϵ�д�����Ŀ���ᡢ�����������Ҫ���ʣ�
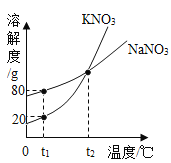
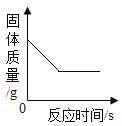
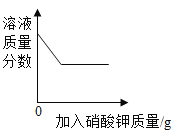
(1)ʵ��������һƿ���ڷ��õ�Ũ���ᣮ�������������ͷ��������Ĺ�ϵ��ͼ������ˮ������������Ũ������������������仯��ԭ��_____��
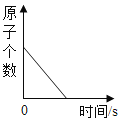
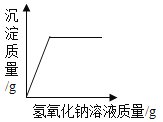
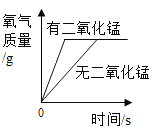
(2)�۲�ͼƬ����С�Թ��ڵμ�ˮ�����������ƹ����ܽ��⣬���ɹ۲쵽��������_____�����Ͳ����������ԭ��_____��_____��
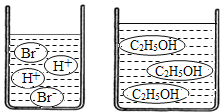
(3)��ͼ�ֱ����廯��(HBr)���Ҵ�(C2H5OH)��ˮ�е���ʾ��ͼ�����������е��ᡢ��֪ʶ���ж��廯���ˮ��Һ��_____���Ҵ���ˮ��Һ��_____(������������������������������)��
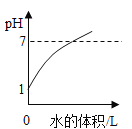
(4)��ʢ��10mLϡ����(���е�������ָʾ��)���ձ��м�������������Һ����pH�Ʋⶨ��Һ��pH�������������£���������ش��������⣺
����NaOH��Һ�����/mL | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 |
�ձ�����Һ��pH | 1.1 | 1.2 | 1.4 | 1.6 | 2.5 | 7.0 | 11.0 | 12.0 |
�����μӵ�ָʾ������ɫʯ����Һ������������������Һ�����Ϊ13mLʱ����Һ��_____ɫ��
�����μ�ָʾ������ɫ��̪��Һ��������������Һ�������Һ��ɫ�ޱ仯����ʱ��Һ�е�����һ����(�ѧʽ)_____��������_____��