题目内容
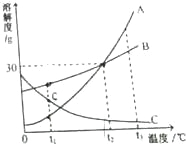
【题目】甲、乙两种固体物质的溶解度曲线如图所示,从中获取的信息不正确的是
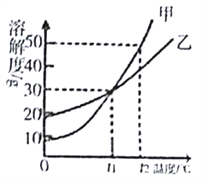
A. t1℃时甲和乙两种物质的溶解度相同
B. 甲和乙的饱和溶液从t2℃降温至t1℃均有晶体析出
C. t2℃时将60g的甲溶解于100g水中,所得溶液的溶质质量分数为37.5%
D. t2℃时甲的溶解度大于乙的溶解度
【答案】C
【解析】A、根据溶解度曲线可知,t1℃时甲和乙两种物质的溶解度相同,正确;B、甲和乙的溶解度都随温度的降低而降低,甲和乙的饱和溶液从t2℃降温至t1℃均有晶体析出,正确;C、t2℃时甲的溶解度为50g,t2℃时100g水中溶解50g的甲达到饱和,t2℃时将60g的甲溶解于100g水中,所得溶液是饱和溶液,一定温度下,饱和溶液的溶质质量分数=![]() ×100%,所得溶质质量分数=
×100%,所得溶质质量分数=![]() ×100%=33.3%,错误;D、根据溶解度曲线可知,t2℃时甲的溶解度大于乙的溶解度,正确。故选C。
×100%=33.3%,错误;D、根据溶解度曲线可知,t2℃时甲的溶解度大于乙的溶解度,正确。故选C。

【题目】实验室有一瓶标签破损的硫酸。为测定该瓶硫酸溶液的溶质质量分数,小强同学在烧杯中加入50g该硫酸,然后向烧杯中滴加溶质质量分数为10%的氢氧化钠溶液,边滴加边搅拌,随着氢氧化钠溶液的滴入,溶液的pH变化情况如下表所示,请分析并计算:
氢氧化钠溶液的质量/g | 溶液的pH | 所得溶液 |
30 | pH<7 | a |
40 | pH =7 | b |
45 | pH>7 | c |
(1)a、b、c三种溶液中只含一种溶质的是________。
(2)该瓶硫酸溶液的溶质质量分数是多少____?(写出解题过程)(H2SO4+2NaOH==Na2SO4+2H2O)
【题目】拉瓦锡曾用水蒸气通过红热的铁制枪管制得氢气,兴趣小组利用下图装置研究水蒸气与铁的反应。
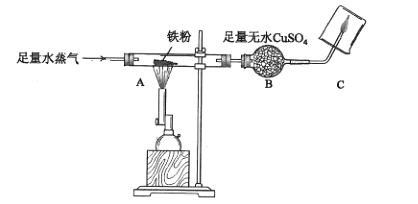
①取4.2g铁粉按上图进行实验,观察到A处玻璃管中灰色铁粉逐渐变黑,B处白色固体变为蓝色,B处发生反应的化学方程式为_______,无水硫酸铜的作用是_______;C处可观察到的现象是___________。
②实验停止后,同学们对玻璃管中黑色固体的成分进行探究。
【提出猜想】黑色固体是含铁化合物。
【查阅资料】FeO和Fe3O4是常见的两种黑色含铁化合物;
FeO遇空气会立即变为红棕色
【进行实验】将黑色固体平铺与白纸上,试纸未见红棕色,可知黑色固体中不含_____。
经称量,黑色固体为5.8g。
【交流反思】黑色固体中还可能含有铁粉,继续探究如下:
(铁的氧化物均不与硫酸铜溶液反应)
实验操作 | 实验现象 | 实验结论 |
将黑色固体全部倒入烧杯并加入足量硫酸铜溶液。 | _________ | 黑色固体中不含铁粉 |
【实验结论】
Ⅰ水蒸气与铁发生反应的化学方程式为_________,该反应____(填“能”或“不能”)证明水是一种化合物。
Ⅱ利用本实验数据,列式表示黑色固体中铁、氧原子的物质的量之比_____(不要求计算)。