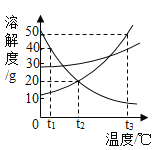
题目内容
【题目】在研究酸和碱的化学性质时,同学发现稀 H2SO4 与 NaOH溶液混合后无明显现象产生,于是设计并完成了如下实验方案
方案一:测定稀 H2SO4与 NaOH溶液混合前后的 pH
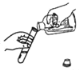
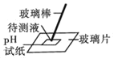
(1)将 pH试纸伸入某 NaOH溶液中测定 NaOH溶液的 pH,测得 pH_____7(选填“大于”“等于”或“小于”);
(2)将一定量的稀 H2SO4加入该 NaOH溶液中,混合均匀后测定其 pH,pH=7
方案二:向盛有 NaOH溶液的烧杯中先滴加酚酞试液,后滴加稀硫酸,观察到溶液由红色变成无色
结论:稀 H2SO4与 NaOH溶液发生了化学反应,反应的化学方程式为:_____;
上述实验操作中错误的是_____
【答案】大于 ![]() 将pH试纸伸入NaOH溶液
将pH试纸伸入NaOH溶液
【解析】
(1)NaOH属于碱,其溶液呈碱性,用pH试纸测定 NaOH溶液的 pH,测得 pH大于7。
(2)稀 H2SO4与 NaOH溶液发生化学反应,生成水和硫酸钠,反应的化学方程式为![]() ;上述实验操作中错误的是在测定某NaOH溶液的 pH时,将pH试纸伸入NaOH溶液中测定,这样做会使原氢氧化钠溶液受到污染,应用玻璃棒蘸取氢氧化钠溶液滴在pH试纸来测定。
;上述实验操作中错误的是在测定某NaOH溶液的 pH时,将pH试纸伸入NaOH溶液中测定,这样做会使原氢氧化钠溶液受到污染,应用玻璃棒蘸取氢氧化钠溶液滴在pH试纸来测定。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目