题目内容
【题目】质量守恒定律的定量研究对化学科学发展具有重大作用.
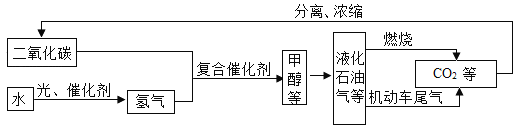
(1)用化学方法可将过度排放的二氧化碳“变废为宝”.在一定条件下,二氧化碳和氢气可实现以下转化: ,其中x的化学式为_________。
,其中x的化学式为_________。
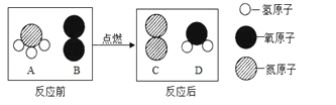
(2)如图为某化学反应的微观模拟图,“![]() ”和“
”和“![]() ”分别表示不同元素的原子:
”分别表示不同元素的原子:
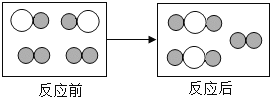
由“![]() ”聚集成的物质___________(填“可能”或“不可能”)是氧化物,参加反应的两种反应物分子“
”聚集成的物质___________(填“可能”或“不可能”)是氧化物,参加反应的两种反应物分子“![]() ”与“
”与“![]() ”的个数比为___________。
”的个数比为___________。
(3)已知mg镁条放在空气中完全燃烧,生成ng氧化镁(不考虑其它反应),比较m和n的质量关系,m___________n.(填“大于”、“小于”或“等于”)。
【答案】CO 可能 2:1 小于
【解析】
(1)根据质量守恒定律,化学反应前后元素的种类和原子的个数不变,反应前C:1、H;2、O:2,反应后H:2、O:1,故X的化学式为:CO;
(2)将图中前后无变化的微粒去除得图:
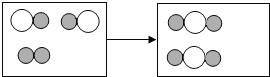
图示表示 由“![]() ”聚集成的物质由两种元素组成,可能一种为氧元素,所以该物质可能为氧化物;“
”聚集成的物质由两种元素组成,可能一种为氧元素,所以该物质可能为氧化物;“![]() ”与“
”与“![]() ”的个数比为,两种反应物分子个数比为2:1;
”的个数比为,两种反应物分子个数比为2:1;
(3)镁条与氧气在点燃的条件下反应生成氧化镁,根据质量守恒定律,生成氧化镁的质量=参加反应的镁的质量+氧气的质量,所以m小于n;

 名校课堂系列答案
名校课堂系列答案【题目】某校兴趣小组在实验室中完成制取氧气的实验。他们取氯酸钾和二氧化锰的混合物共3.0g放入大试管中加热,并在不同时刻测定试管内剩余固体物质的质量(如下表):分析表中数据,完成下列问题:
反应时间/min | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 |
剩余固体质量g | 2.55 | 2.25 | 2.10 | 2.04 | 2.04 |
(1)完全反应后,生成氧气的质量为_____g
(2)二氧化锰中锰元素的质量分数_____
(3)原混合物中氯酸钾的质量分数是多少_____?(精确到0.1%)