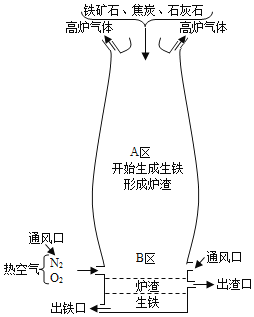
题目内容
【题目】t1℃时,将甲、乙、丙三种固体各20克,分别加入盛有50克水的烧杯中,充分溶解后的情况如下表
物质 | 甲 | 乙 | 丙 |
未溶解的固体/g | 5.4 | 0 | 2 |
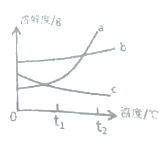
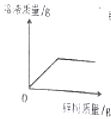
(1)一定是饱和溶液的是_______,t1℃时丙的溶解度为_______。
(2)图中表示固体甲的曲线是________。
(3)t1℃时,甲乙丙的溶解度大小关系为_______。
(4)t2℃时,取等质量的甲乙丙的饱和溶液,分别恒温蒸发等质量的水,析出溶质质量的大小关系为______(用甲乙丙表示)
【答案】甲、丙 36g c 乙>丙>甲 丙>乙>甲
【解析】
(1)由题中信息可知,t1℃时,将甲、乙、丙三种固体各20克,分别加入盛有50克水的烧杯中,充分溶解后,甲、丙均有剩余固体,所以一定是饱和溶液的是甲、丙,t1℃时丙在50g水中最多溶解18g,在100g水中最多溶解36g,t1℃时溶解度为36g;
(2)t1℃时甲固体剩余最多,所以t1℃时,甲的溶解度最小,图中表示固体甲的曲线是c;
(3)由题中信息可知,t1℃时,甲乙丙的溶解度大小关系为乙>丙>甲;
(4)由t2℃时的溶解度和表格中数据可知,溶解度曲线对应物质是甲-c,乙-b,丙-a,t2℃时,甲乙丙的溶解度大小关系为丙>乙>甲,所以饱和溶液中相同质量的水中溶解的溶质大小关系为丙>乙>甲,取等质量的甲乙丙的饱和溶液,分别恒温蒸发等质量的水,析出溶质质量的大小关系为丙>乙>甲。

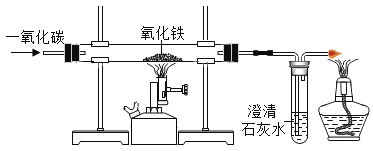
【题目】(1)不同实验对反应速率有不同要求。某同学探究CO2制取实验,按要求答题。 限选控制反应速率的方法:①反应物的浓度 ②反应物的状态
限选试剂:A.稀盐酸 B.浓盐酸 C.块状石灰石 D.碳酸钠溶液 E.粉末状石灰石
填写下表并回答相关问题
实验名称 | 控制速率的方法 | 所选用的最佳试剂 |
灭火器反应原理 | ① | ___________和D |
CO2的实验室制法 | ___________; | A和C |
写出实验室制备CO2的化学反应方程式:______________________。
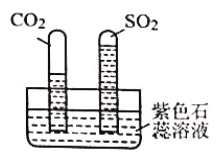
(2)己知:CO2和SO2既有相似性,又有差异性。
实验:水槽中滴入紫色石蕊溶液,将收集满两种气体的试管同时倒立于水槽中,片刻后实验现象如下图所示,说明相同条件下的溶解性:SO2 ___________(填“>”或“<”)CO2,试管内溶液变成___________色。
【题目】请参与下列实验探究:
(实验探究)
实验内容 | 记录数据 |
A.借助新型传感设备探究红磷、白磷在空 气中燃烧时的耗氧情况
| 燃烧红磷:瓶内剩余气体的体积分数为8.85% 燃烧白磷:瓶内剩余氧气的体积分数为3.21% |
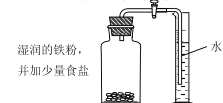
B.用铁生锈原理测定空气中氧气的体积分数
| 反应前测定:广口瓶容积(扣除药品、导管和瓶塞所占容积)为125.0mL 反应后测定:进入广口瓶中的体积为25.0mL |
(1)红磷和白磷是由相同的磷元素组成的不同___________(填“化合物”或“单质”)。进行A实验时,燃烧反应的化学方程式可表示为___________。
(2)实验A的测定结果是在操作无误、装置不漏气,红磷、白磷耗氧差异较大的主要原因___________。
(3)实验B中,下列属于为加快实验进程而采取的措施是___________和___________(填数字编号)。
①在集气瓶中进行 ②塞紧瓶塞不漏气 ③使用铁粉而不使用铁丝 ④加少量食盐
(4)铁生锈的实质是铁与_________(写化学式)发生了化学反应。根据表中记录数据,可计算出空气中氧气的体积分数为__________。
(反思与拓展)
铜在潮湿的空气中生成铜绿化学式为[Cu2(OH)2CO3]时也能耗氧,从化学式可以看出,铜绿的生成是铜与水及空气中的___________发生反应的而过程,所以,实验B_____ (填 “能”或“不能”)用铜粉代替铁粉。