题目内容
实验室用高锰酸钾制取氧气,反应结束后,制得氧气的质量是32g,求:
(1)参与反应的高锰酸钾的质量;
(2)高锰酸钾中氧元素的质量分数;
(3)高锰酸钾中锰元素和钾元素的质量比.
(1)参与反应的高锰酸钾的质量;
(2)高锰酸钾中氧元素的质量分数;
(3)高锰酸钾中锰元素和钾元素的质量比.
考点:根据化学反应方程式的计算,元素质量比的计算,元素的质量分数计算
专题:化学式的计算,有关化学方程式的计算
分析:(1)根据高锰酸钾受热分解的化学方程式,可得知反应中高锰酸钾与氧气的质量关系,再由生成氧气的质量即可计算所需要高锰酸钾的质量;
(2)根据某元素的质量分数=
×100%,计算即可;
(3)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答
(2)根据某元素的质量分数=
| 原子的相对原子质量×原子个数 |
| 相对分子质量 |
(3)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答
解答:解:
(1)设需要高锰酸钾的质量为x
2KMnO4
K2MnO4+MnO2+O2↑
2×158 32
x 32g
=
x=316g
(2)高锰酸钾中氧元素的质量分数为:
×100%≈40.5%;
(3)KMnO4中锰元素和钾元素的质量比为55:39;
答案:
(1)参与反应的高锰酸钾的质量为316g
(2)高锰酸钾中氧元素的质量分数为40.5%
(3)KMnO4中锰元素和钾元素的质量比为55:39
(1)设需要高锰酸钾的质量为x
2KMnO4
| ||
2×158 32
x 32g
| 2×158 |
| 32 |
| x |
| 32g |
x=316g
(2)高锰酸钾中氧元素的质量分数为:
| 16×4 |
| 39+55+16×4 |
(3)KMnO4中锰元素和钾元素的质量比为55:39;
答案:
(1)参与反应的高锰酸钾的质量为316g
(2)高锰酸钾中氧元素的质量分数为40.5%
(3)KMnO4中锰元素和钾元素的质量比为55:39
点评:本题为根据化学方程式计算类问题中的基础计算,完整的计算步骤、规律的书写格式是解答此类问题时需要留意的地方.

练习册系列答案
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案
相关题目
下列物质中属于共价化合物的是( )
| A、KClO3 |
| B、KCl |
| C、H2S |
| D、Na2O |
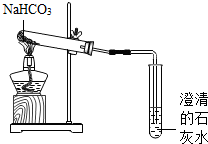 NaHCO3是一种重要的盐,设计实验探究其性质.
NaHCO3是一种重要的盐,设计实验探究其性质.
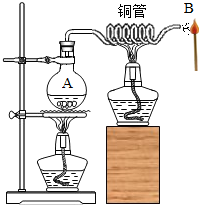 水蒸气能点燃火柴吗?做如图所示实验,加热烧瓶中的水使之沸腾,水蒸气通过加热的铜管喷出;把火柴靠近铜管口处,火柴被加热;迅速从水蒸气中移开,火柴燃着了.
水蒸气能点燃火柴吗?做如图所示实验,加热烧瓶中的水使之沸腾,水蒸气通过加热的铜管喷出;把火柴靠近铜管口处,火柴被加热;迅速从水蒸气中移开,火柴燃着了.