题目内容
【题目】金属在日常生活中有着广泛的用途.
(1)铝块能制成铝铂是利用了铝的__________性.
(2)可以判断铜、锌、银三种金属活动性顺序的一组试剂是_____(填字母).
A银、锌、硫酸铜溶液 B铜、银、硫酸锌溶液 C硫锌锌、硝酸银溶液、铜
(3)我国是世界上最早采用湿法冶金提取铜的国家,请写出铁与硫酸铜溶液反应制取铜的化学方程式__________;若用这种方法制取铜,11.67t含杂质4%的生铁完全反应,在理论上可制取铜的质量为__________ t(计算结果保留一位小数).
(4)将5.6g含有一种杂质的铁粉与足量的稀盐酸反应,生成0.21g氢气,则该铁粉中混入的杂质是 ______(填“铜”或“铝”);把这种铁粉放入硝酸银溶液中,充分反应后过滤,得滤渣和滤液.向滤渣中滴入稀硫酸,若无气泡产生,则滤液中一定含有的溶质是__________(填化学式).
【答案】延展 AC Fe+CuSO4=FeSO4+Cu 12.8t 铝 Al(NO3)3,Fe(NO3)2
【解析】
(1)根据金属的物理性质进行分析;
(2)根据排在前面的金属可以将排在后面的金属从其盐溶液中置换出来进行分析;
(3)根据铁和硫酸铜反应生成硫酸亚铁和铜,依据题中的数据和化学方程式进行计算;
(4)根据铁与盐酸反应的化学方程式可以计算出5.6g纯铁能生成0.2g氢气,由于0.2g<0.21g,说明不纯的铁中所含的杂质能与盐酸反应且能产生氢气,而且等质量的铁和所含杂质相比,杂质与盐酸反应产生的氢气多;
根据金属活动性顺序表的应用分析判断滤液中一定含有的溶质的成分.
解:(1)铝块能制成铝箔是利用了铝的延展性;
(2)A.银、锌、硫酸铜溶液,锌会与硝酸铜反应,银不会与硝酸铜反应,可以验证,故正确;
B.铜、银、硫酸锌溶液,铜、银都不会与硝酸锌反应,不能验证,故错误;
C.硫酸锌、硝酸银溶液、铜,铜不会与硫酸锌反应,会与硝酸银反应,可以验证,故正确;
故选:AC;
(3)铁和硫酸铜反应生成硫酸亚铁和铜,化学方程式为:Fe+CuSO4=FeSO4+Cu;
设理论上可以制取铜的质量为x
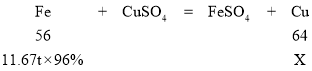
![]() =
=![]()
x=12.8t
(4)设5.6g纯铁与盐酸反应生成氢气的质量为y。
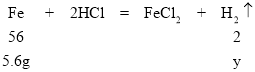
![]() =
=![]()
y=0.2g<0.21g
说明不纯的铁中所含的杂质能与盐酸反应且能产生氢气,而且等质量的铁和所含杂质相比,杂质与盐酸反应产生的氢气多,由于铜不能与盐酸反应,杂质不可能为铜,由于等质量的铝与盐酸反应时产生的氢气比铁多,应混入了铝;
由题意可知,把这种铁粉放入硝酸银溶液中,铝先与硝酸银反应,反应完后铁再与硝酸银反应,充分反应后,过滤,将滤渣洗净,滴入稀硫酸,如果无气泡产生,说明了铝、铁无剩余,滤液中一定含有的溶质是:Al(NO3)3,Fe(NO3)2.

 阅读快车系列答案
阅读快车系列答案