题目内容
【题目】酸、碱、盐是九年级化学学习的重要知识,并且它们具有广泛的用途。
(1)下列关于酸、碱、盐的生产或应用中的说法合理的是_________。
A将氯化铵与草木灰混合施用
B烧碱既可以从内陆盐湖提取,又可用侯氏联合制碱法制取
C用小苏打治疗胃酸过多
D高温煅烧生石灰可以得到熟石灰
(2)盐酸和硫酸是初中化学常见的酸,它们有很多相似的化学性质,因为其溶液中都含有______(填离子符号)。打开盛放浓硫酸和浓盐酸的试剂瓶盖后,立即就能把它们区分开来,原因是什么?______
(3)现象不明显的化学反应通过数字化实验技术可以实现反应过程的“可视化”。某兴趣小组将CO2持续通入一定浓度一定量的NaOH溶液中,用数字化实验技术测得反应过程中溶液的pH变化情况如图所示。
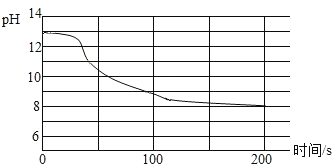
①写出二氧化碳与氢氧化钠反应的化学方程式:__________。
②溶液pH始终都大于7,原因是________。
(4)为了除去氯化钠溶液中含有的CaCl2和MgSO4杂质,先向溶液中加入过量的Ba(OH)2溶液和过量的Na2CO3溶液,充分反应后过滤,则滤渣中含有的物质为________;向滤液加入适量稀盐酸,将反应所得溶液蒸发结晶,即可得到纯净的氯化钠固体。则在蒸发操作时用玻璃棒搅拌的目的是______。
(5)10g碳酸钙与100g稀盐酸正好完全反应,生成4.4g二氧化碳,则反应所得氯化钙溶液的溶质质量分数为多少(准确到0.1%)?______
【答案】C H+ 浓盐酸有挥发性,在瓶口会形成白雾 ![]() 氢氧化钠溶液及反应生成的碳酸钠溶液均显碱性 硫酸钡、氢氧化镁、碳酸钡、碳酸钙 防止局部温度过高,造成液滴飞溅 10.5%
氢氧化钠溶液及反应生成的碳酸钠溶液均显碱性 硫酸钡、氢氧化镁、碳酸钡、碳酸钙 防止局部温度过高,造成液滴飞溅 10.5%
【解析】
(1)A、草木灰显碱性,与氯化铵反应生成氨气,氮元素被释放到空气中,不利于植物吸收,选项A不合理;
B、烧碱为氢氧化钠俗称,侯氏制碱法制得是碳酸钠,选项B不合理;
C、小苏打为碳酸氢钠,与盐酸反应生成氯化钠、水和二氧化碳,可以降低酸的浓度,治疗胃酸,选项C合理;
D、生石灰为氧化钙,高温煅烧不发生反应,无法形成熟石灰氢氧化钙,选项D不合理;故选C。
(2)盐酸与硫酸都是酸,其化学性质由氢离子决定;浓盐酸具有挥发性,打开瓶口后会形成白雾,而浓硫酸具有吸水性,不会形成白雾;
故答案为:H+;浓盐酸有挥发性,在瓶口会形成白雾。
(3)①二氧化碳与氢氧化钠反应生成碳酸钠和水,书写化学方程式注意配平,所以该反应为![]() ;
;
故答案为:![]() 。
。
②氢氧化钠与碳酸钠水溶液都是显碱性的,所以溶液的pH始终是比7大;
故答案为:氢氧化钠溶液及反应生成的碳酸钠溶液均显碱性。
(4)氢氧化钡与硫酸镁反应生成硫酸钡沉淀和氢氧化镁沉淀,碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠,碳酸钠与氢氧化钡反应生成碳酸钡沉淀和氢氧化钠,所以滤渣为硫酸钡、氢氧化镁、碳酸钙和碳酸钡;蒸发时为了避免局部过热,造成液体飞溅,需要玻璃棒进行搅拌;
故答案为:硫酸钡、氢氧化镁、碳酸钡、碳酸钙;防止局部温度过高,造成液滴飞溅。
(5)设反应所得氯化钙溶液的溶质的质量为x,
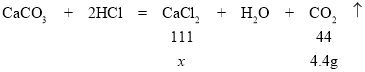
![]()
x=11.1g,
反应所得氯化钙溶液的溶质质量分数=![]()
答:反应所得氯化钙溶液的溶质质量分数为10.5%。
故答案为:10.5%。

 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案