题目内容
【题目】为测定某AgNO3溶液的溶质质量分数,用溶质质量分数为7.3%的稀盐酸进行滴定.现取待测液50.0g,滴定过程如图所示.(滴定反应为:AgNO3+HCl═AgCl↓+HNO3 , 计算结果均保留1位小数) 
(1)AgNO3溶液的溶质质量为g;
(2)计算恰好完全反应时,所得溶液的溶质质量分数.
【答案】
(1)3.4
(2)解:恰好完全反应时消耗10.0g稀盐酸,所得溶液的溶质质量分数为: ![]() ×100%=2.2%
×100%=2.2%
【解析】解:(1)设硝酸银的质量为x,反应生成硝酸质量为y, 由图中信息可知,反应生成氯化银沉淀的质量是2.87g,
HCl+ | AgNO3═ | AgCl↓+ | HNO3 , |
170 | 143.5 | 63 | |
x | 2.87 | y |
![]() =
= ![]() =
= ![]() ,
,
x=3.4g,y=1.26g,
故填:3.4.
硝酸银和稀盐酸反应生成白色沉淀氯化银和硝酸,根据反应的化学方程式和图中通过的数据可以进行相关方面的计算.

 名校课堂系列答案
名校课堂系列答案【题目】在各种金属材料中铜是人类应用比较广泛的金属之一,某学习小组欲测定铜的相对原子质量,设计如下实验方案: 查阅资料知:(1)碱石灰可以吸收水蒸气、二氧化碳等气体.(2)氯化氢极易溶于水
实验步骤:①连接好装置 ②③装入药品 ④打开分液漏斗活塞向锥形瓶中滴加入稀盐酸 ⑤一段时间点燃酒精灯 ⑥D中黑色固体完全变成红色,停止加热,待D中玻璃管冷却至室温,关闭分液漏斗活塞 ⑦数据处理
请回答下列问题:
(1)实验步骤②是 , 如下图,保持装置内温度不变,将导管的末端伸入装有水的烧杯中,若效果良好,烧杯内导管处的现象(画圈部分)是 .
选项 | A | B | C | D |
|
现象放大图 |
|
|
|
|
(2)若使制取氢气是装置随开随用,随关随停,下列装置可选用的是 . 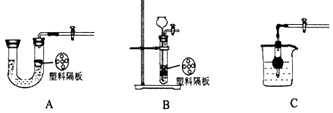
(3)B装置中水的作用 , C装置的作用
(4)已知:CuO样品质量为m1克,E中增重为m2克,D中反应后固体质量为m3克,实际参加反应氢气的质量为m4克,试用m1 , m2列出铜的相对原子质量的表达式 , 若无F装置,则对测定结果的影响(填“偏大”、“偏小”、“无影响”).
(5)请你评价实验有什么不妥之处,并说明原因 .
(6)利用A装置,加入其他药品,还可以制取的气体是(填一种).