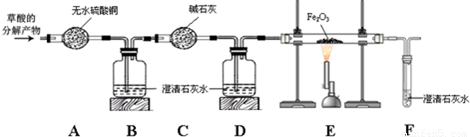
题目内容
碱石灰是氧化钙和氢氧化钠的固体混合物,是实验室常用的干燥剂.相关信息如下表所示.同学们为确认一瓶久置的“碱石灰”(可能已部分变质或全部变质)样品的成分,进行如下探究.| [小资料] ①碱石灰是氧化钙、氢氧化钙的固体混合物.易吸收空气中的水蒸气和二氧化碳. ②氯化钙溶液显中性. |
[进行猜想]久置的碱石灰样品中可能含有CaO、NaOH、Na2CO3、Ca(OH)2、CaCO3等成分.用化学方程式表示样品中含有Ca(OH)2或Na2CO3可能含有的原因______(写一个).
[探究过程]

试回答下列问题:
(1)操作①的名称是______,溶液C中一定含______离子.
(2)溶液A中加入CaCl2溶液后产生固体,说明样品中一定含有______,反应的方程式为______.
(3)向溶液A中加入CaCl2溶液后,证明CaCl2溶液过量的方法是______.
[实验结论]
依据上述实验操作过程及现象,综合对滤液和固体成分的探究,下列对样品成分的分析正确的是______(填序号).
①样品中一定含NaOH
②样品中一定含Na2CO3
③样品中含NaOH、CaO中的一种或两种
[拓展延伸]
为测定实验室中一瓶变质的烧碱中NaOH的含量,某同学取适量的烧碱样品,溶于一定量的水得到200g溶液;再加入200g稀硫酸(足量)充分搅拌到不再放出气泡为止,称量溶液为395.6g.请分析计算:
(1)反应产生的CO2的质量为______ g.
(2)若所取烧碱样品为50.0g,则样品中NaOH的质量分数是多少?(写出计算过程)______.
(3)用同浓度的硫酸,分别与未变质、部分变质、或全部变质(杂质都是Na2CO3)的烧碱样品反应,需要硫酸的质量都相等.从钠元素质量守恒的角度解释其原因是:______.
【答案】分析:[进行猜想]根据题目信息可知,碱石灰的成分是氧化钙和氢氧化钠,氧化钙和水生成氢氧化钙,氢氧化钠和二氧化碳生成碳酸钠.写出方程式;
[实验过程]
(1)浊液分离成固体B和溶液A,过滤的使用范围就是把不溶性固体和液体分离,酚酞遇碱变红.
(2)根据物质的组成可知,碳酸钠和氯化钙反应生成碳酸钙和氯化钠.
(3)检验物质一般选用生成沉淀或者气体的反应,碳酸钠和氯化钙反应生成碳酸钙和氯化钠.
[实验结论]根据流程图分析,判断哪些是肯定存在,哪些是可能
[拓展延伸]根据质量差分析并按照化学方程式的步骤书写出完整的过程.
解答:解:[进行猜想]根据题目信息可知,碱石灰的成分是氧化钙和氢氧化钠,氧化钙和水生成氢氧化钙,氢氧化钠和二氧化碳生成碳酸钠.故答案为:CaO+H2O═Ca(OH)2(或2NaOH+CO2═Na2CO3+H2O等,答案合理即可)
[实验过程]
(1)浊液分离成固体B和溶液C,不溶性固体和液体分离符合过滤的使用范围;根据酸碱指示剂的变色范围可知,碱性物质能使酚酞试液变成红色,而碱的共同特征是都含有 OH-
.故答案为:过滤,OH-.
(2)根据物质的组成可知,只有碳酸钠可以和氯化钙反应生成碳酸钙沉淀.故答案为:碳酸钠,Na2CO3+CaCl2═2NaCl+CaCO3↓
(3)检验物质一般选用生成沉淀或者气体的反应,碳酸钠和氯化钙反应生成碳酸钙和氯化钠.故答案为:取溶液C于试管中滴加碳酸钠溶液,有白色沉淀生成.
[实验结论]样品溶于水后,烧杯内壁发热,说明有氧化钙或者是氢氧化钠,氧化钙和水反应放出较多热量,氢氧化钠是溶解放热;过滤得到固体B,说明B是碳酸钙(这个碳酸钙可能是氧化钙与二氧化碳反应的结果,也包含氢氧化钠变质后的碳酸钠与氢氧化钙反应的结果;溶液A中加入氯化钙生成碳酸钙沉淀,说明含有碳酸钠;由于加入了过量的氯化钙溶液,所以在溶液C中无碳酸钠剩余,当酚酞呈现红色时说明有碱性物质存在,由于加入的氯化钙对应沉淀,所以A中无氢氧化钙溶液,所以C处只能是氢氧化钠存在..则原混合物中一定含有碳酸钠和氢氧化钠.故答案为:①②③.
[拓展延伸]
(1)根据反应前后质量差:200克+200克-395.6克=4.4克就是二氧化碳的质量;
(2)解:设所取样品中含有Na2CO3的质量为x.
Na2CO3+H2SO4═Na2 SO4+H2O+CO2↑
106 44
x 4.4g
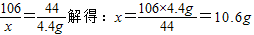
则烧碱样品中 NaOH%=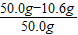 ×100%=78.8%
×100%=78.8%
答:烧碱样品中NaOH的质量分数为78.8%.
(3)2NaOH+H2SO4=Na2SO4+2H2O Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
根据元素守恒的角度看,从两个方程式均可得出都是每46g钠元素生成142g硫酸钠,消耗98g硫酸.
故答案为:
[进行猜想]CaO+H2O═Ca(OH)2(或2NaOH+CO2═Na2CO3+H2O等,答案合理即可)
[实验过程](1)过滤 OH-
(2)碳酸钠 Na2CO3+CaCl2═2NaCl+CaCO3↓
(3)取溶液C于试管中滴加碳酸钠溶液,有白色沉淀生成,说明CaCl2溶液已过量
[实验结论](1)①②③
[拓展延伸]
(1)4.4
(2)解:设所取样品中含有Na2CO3的质量为x.
Na2CO3+H2SO4═Na2 SO4+H2O+CO2↑
106 44
x 4.4g
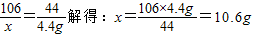
则烧碱样品 NaOH%=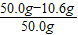 ×100%=78.8%
×100%=78.8%
答:烧碱样品中NaOH的百分含量为78.8%.
(3)氢氧化钠和碳酸钠都是每46g钠元素生成142g硫酸钠,消耗98g硫酸
点评:[实验结论]不好处理,做题时要前后对照,因果要清楚,酚酞变红的因素较多,比如氧化钙、氢氧化钠、氢氧化钙等.
[实验过程]
(1)浊液分离成固体B和溶液A,过滤的使用范围就是把不溶性固体和液体分离,酚酞遇碱变红.
(2)根据物质的组成可知,碳酸钠和氯化钙反应生成碳酸钙和氯化钠.
(3)检验物质一般选用生成沉淀或者气体的反应,碳酸钠和氯化钙反应生成碳酸钙和氯化钠.
[实验结论]根据流程图分析,判断哪些是肯定存在,哪些是可能
[拓展延伸]根据质量差分析并按照化学方程式的步骤书写出完整的过程.
解答:解:[进行猜想]根据题目信息可知,碱石灰的成分是氧化钙和氢氧化钠,氧化钙和水生成氢氧化钙,氢氧化钠和二氧化碳生成碳酸钠.故答案为:CaO+H2O═Ca(OH)2(或2NaOH+CO2═Na2CO3+H2O等,答案合理即可)
[实验过程]
(1)浊液分离成固体B和溶液C,不溶性固体和液体分离符合过滤的使用范围;根据酸碱指示剂的变色范围可知,碱性物质能使酚酞试液变成红色,而碱的共同特征是都含有 OH-
.故答案为:过滤,OH-.
(2)根据物质的组成可知,只有碳酸钠可以和氯化钙反应生成碳酸钙沉淀.故答案为:碳酸钠,Na2CO3+CaCl2═2NaCl+CaCO3↓
(3)检验物质一般选用生成沉淀或者气体的反应,碳酸钠和氯化钙反应生成碳酸钙和氯化钠.故答案为:取溶液C于试管中滴加碳酸钠溶液,有白色沉淀生成.
[实验结论]样品溶于水后,烧杯内壁发热,说明有氧化钙或者是氢氧化钠,氧化钙和水反应放出较多热量,氢氧化钠是溶解放热;过滤得到固体B,说明B是碳酸钙(这个碳酸钙可能是氧化钙与二氧化碳反应的结果,也包含氢氧化钠变质后的碳酸钠与氢氧化钙反应的结果;溶液A中加入氯化钙生成碳酸钙沉淀,说明含有碳酸钠;由于加入了过量的氯化钙溶液,所以在溶液C中无碳酸钠剩余,当酚酞呈现红色时说明有碱性物质存在,由于加入的氯化钙对应沉淀,所以A中无氢氧化钙溶液,所以C处只能是氢氧化钠存在..则原混合物中一定含有碳酸钠和氢氧化钠.故答案为:①②③.
[拓展延伸]
(1)根据反应前后质量差:200克+200克-395.6克=4.4克就是二氧化碳的质量;
(2)解:设所取样品中含有Na2CO3的质量为x.
Na2CO3+H2SO4═Na2 SO4+H2O+CO2↑
106 44
x 4.4g
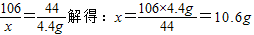
则烧碱样品中 NaOH%=
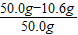 ×100%=78.8%
×100%=78.8% 答:烧碱样品中NaOH的质量分数为78.8%.
(3)2NaOH+H2SO4=Na2SO4+2H2O Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
根据元素守恒的角度看,从两个方程式均可得出都是每46g钠元素生成142g硫酸钠,消耗98g硫酸.
故答案为:
[进行猜想]CaO+H2O═Ca(OH)2(或2NaOH+CO2═Na2CO3+H2O等,答案合理即可)
[实验过程](1)过滤 OH-
(2)碳酸钠 Na2CO3+CaCl2═2NaCl+CaCO3↓
(3)取溶液C于试管中滴加碳酸钠溶液,有白色沉淀生成,说明CaCl2溶液已过量
[实验结论](1)①②③
[拓展延伸]
(1)4.4
(2)解:设所取样品中含有Na2CO3的质量为x.
Na2CO3+H2SO4═Na2 SO4+H2O+CO2↑
106 44
x 4.4g
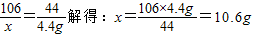
则烧碱样品 NaOH%=
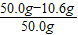 ×100%=78.8%
×100%=78.8%答:烧碱样品中NaOH的百分含量为78.8%.
(3)氢氧化钠和碳酸钠都是每46g钠元素生成142g硫酸钠,消耗98g硫酸
点评:[实验结论]不好处理,做题时要前后对照,因果要清楚,酚酞变红的因素较多,比如氧化钙、氢氧化钠、氢氧化钙等.

练习册系列答案
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案
相关题目