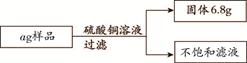
题目内容
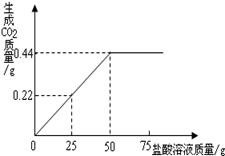
某兴趣小组用10g镁条与溶质质量分数为49%的稀硫酸反应.测得产生氢气的质量与稀硫酸的质量关系如图(假设镁条中除表面含有氧化镁外,没有其它杂质)
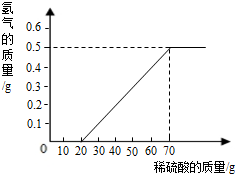
(1)当稀硫酸的质量为70g,产生的氢气的质量为0.5g
(2)用化学方程式说明当稀硫酸的质量为10g时,为什么不产生氢气 ;
(3)计算镁条中镁元素的质量分数(写出计算过程)

(1)当稀硫酸的质量为70g,产生的氢气的质量为0.5g
(2)用化学方程式说明当稀硫酸的质量为10g时,为什么不产生氢气 ;
(3)计算镁条中镁元素的质量分数(写出计算过程)
(1)0.5 (2)MgO+H2SO4=MgSO4+H2O (3)84%
(1)由产生氢气的质量与稀硫酸的质量关系图可知,当稀硫酸的质量为70g,产生的氢气的质量为0.5g;
(2)由于镁易于空气中的氧气反应在镁条的表面生成了氧化镁,稀硫酸首先与镁条表面的氧化镁薄膜发生了反应,所以不产生氢气,反应的方程式是:MgO+H2SO4=MgSO4+H2O
(3)设镁元素的质量为x
由Mg+H2SO4=MgSO4+H2↑ MgO+H2SO4=MgSO4+H2O
H2SO4~MgSO4~Mg
98 24
70×49% X
解得:x=8.4g
镁条中镁元素的质量分数是: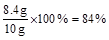
(2)由于镁易于空气中的氧气反应在镁条的表面生成了氧化镁,稀硫酸首先与镁条表面的氧化镁薄膜发生了反应,所以不产生氢气,反应的方程式是:MgO+H2SO4=MgSO4+H2O
(3)设镁元素的质量为x
由Mg+H2SO4=MgSO4+H2↑ MgO+H2SO4=MgSO4+H2O
H2SO4~MgSO4~Mg
98 24
70×49% X
解得:x=8.4g
镁条中镁元素的质量分数是:

练习册系列答案
相关题目
 CO + H2。
CO + H2。