题目内容
(8分)
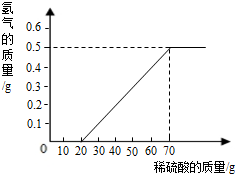
某化学兴趣小组使用下图所示装置,对某种锌铜合金的成分进行测量。先取足量稀硫酸于烧杯中,再向其中加入15.0g合金样品开始计时,并将电子天平的读数记录在下表中,完成下列计算:

(1)反应完全后产生氢气的质量是多少?
(2)锌铜合金中铜的质量是多少?
(3)反应完全后溶液中溶质的质量分数是多少?
某化学兴趣小组使用下图所示装置,对某种锌铜合金的成分进行测量。先取足量稀硫酸于烧杯中,再向其中加入15.0g合金样品开始计时,并将电子天平的读数记录在下表中,完成下列计算:

(1)反应完全后产生氢气的质量是多少?
(2)锌铜合金中铜的质量是多少?
(3)反应完全后溶液中溶质的质量分数是多少?
| | 空烧杯 | 加入硫酸后 | 加入合金后 5分钟 | 加入合金后 10分钟 | 加入合金后 30分钟 |
| 读数(g) | 21.3 | 169.7 | 184.6 | 184.3 | 184.3 |
(1)0.4g (2)2g (3)20%
试题分析:数据分析处理,加入硫酸后的质量为169.7g,再向其中加入15.0g合金样品,则开始反应的总质量为:169.7g+15.0g=184.7g,随着反应的进行,不断产生氢气,质量不断减少,直至质量不再发生变化,表示反应结束(1)根据质量守恒定律,产生氢气的质量=184.7g-184.3g=0.4g
(2)根据化学反应:Zn + H2SO4 ="==" ZnSO4 + H2↑中氢气与锌的质量关系,即可求出锌的质量,反应后所得的溶液是ZnSO4溶液,通过氢气与ZnSO4的质量关系,即可求出ZnSO4的质量,进而可求反应完全后溶液中溶质的质量分数
解:设设合金中Zn的质量为x,生成的ZnSO4质量为y
Zn+H2SO4=ZnSO4+H2↑
65 161 2
x y 0.4g
65∶x =2∶0.4 g x=13 g
161∶y=2∶0.4 g y=32.2g
(2)锌铜合金中铜的质量为:15g-13 g=2g
(3)烧杯中溶液的质量为:184.3g-2g-21.3g=161.0g
∴ 反应完全后溶液中溶质的质量分数=32.2g/161g×100%=20%

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目