题目内容
【题目】金属钨(W)可做白炽灯泡的灯丝。用黑钨矿(主要含 FeWO4)制得金属钨的工艺流程如下图所示:
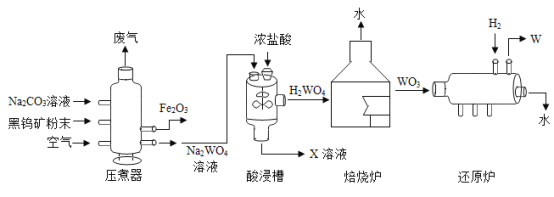
(1)将黑钨矿石碾成粉末,目的是_________。
(2)酸浸槽中,发生了复分解反应,化学方程式为_________。
(3)还原炉中,反应前后,元素化合价降低的元素是_________。
【答案】增大反应物的接触面积,加快反应速率 Na2WO4+2HCl =H2WO4+2NaCl 钨元素
【解析】
(1)接触面积越大,反应越快,将黑钨矿石碾成粉末,目的是增大反应物的接触面积,加快反应速率。
(2)酸浸槽中,Na2WO4和浓HCl发生了复分解反应,生成H2WO4和NaCl,,化学方程式为Na2WO4+2HCl =H2WO4+2NaCl。
(3)还原炉中,三氧化钨和氢气反应生成钨和水,反应前后,氧元素化合价不变,钨元素化合价由+6变成0,氢元素化合价由0价变成+1价,元素化合价降低的元素是钨。

 口算题卡北京妇女儿童出版社系列答案
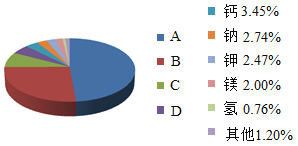
口算题卡北京妇女儿童出版社系列答案【题目】下表为氯化钠和硝酸钾的溶解度:
温度 溶解度/g/100g水 物质 | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 70℃ | 80℃ |
NaCl | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 | 38.4 |
KNO3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 | 169 |
(1)20℃时 KNO3 的溶解度_____(选填“大于”“小 于”)NaCl 的溶解度。随着温度升高,NaCl 的溶解度_____(选填“变大”“变小”或“不变”)。
(2)20℃时,完全溶解 18 g NaCl 恰好得到饱和溶液,所需水的质量是_____g,该溶液质量分数为_____。
(3)20℃时,向 10 g KNO3 固体不断加水,有关图像正确的是_____(选填编号)。
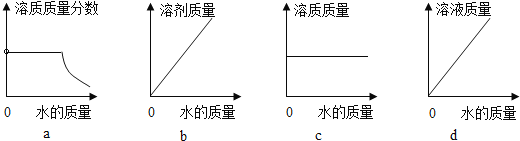
(4)NaCl中含有少量KNO3提纯NaCl采用的方法是_____(选填“蒸发结晶”或“降温结晶”)。
(5)在最新爆发的 “新型肺炎”疫情的医疗上常用溶质质量分数为0.9%的生理盐水为载体给患者输液。某化学兴趣小组欲配制500g溶质质量分数为0.9%的氯化钠溶液。现有如下操作:①装瓶、贴签;②溶解氯化钠;③秤取氯化钠固体;④量取蒸馏水,正确的操作顺序是_____;在量取水时,俯视刻度线会导致所配制溶液的溶质质量分数_____(填“偏大”、“偏小”或“无影响”)。
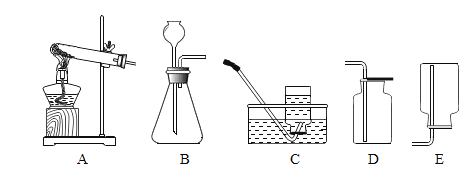
【题目】请从A或B两题中任选一个作答,若两题均作答,按A计分。
A 配制160g 10%的氯化钠溶液 | B去除粗盐中的泥沙 |
(1)实验的主要步骤是:⑤→_____→③。 (2)溶解时,用玻璃棒搅拌的目的是_____。 | (1)实验的主要步骤是:③→_____→②。 (2)蒸发时,用玻璃棒搅拌的目的是_____。 |
可供选择的基本实验操作如图:
| |
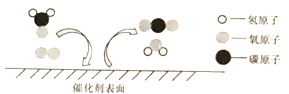
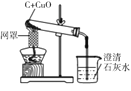
【题目】二氧化锰是不是过氧化氢溶液分解的唯一催化剂?对此小明设计了如下探究方案。
(提出问题)红砖粉末能否作为过氧化氢溶液分解的催化剂?如果能,效果如何?
(实验探究)
实验步骤 | 实验现象 | 实验结论及解释` |
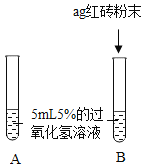
I.
| A中无明显现象,B中产生大量能使带火星木条复燃的气体。 | ①产生的气体是_________。 ②红砖粉末能改变过氧化氢分解速率。 |
Ⅱ.向B试管中重新加入5%的过氧化氢溶液;反应停止后过滤、洗涤、干燥、称量滤渣。 | B又产生大量能使带火星木条复燃的气体;滤渣质量等于ag。 | 红砖粉末的_______、_______在反应前后均没有发生变化,能作过氧化氢分解的催化剂。 |
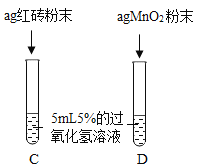
III.
| 两试管中均产生气泡且_______ 。 | 红砖粉末的催化效果没有二氧化锰粉末好。 |
请写出红砖粉末(成分以Fe2O3表示)催化过氧化氢溶液分解反应的化学方程式_______。
(反思)(1)小明在实验时发现试管内有许多水雾,由此推断过氧化氢分解是_______(填“放热”或“吸热”)反应。
(2)实验过程中发现将过氧化氢溶液加入红砖粉末的试管后,反应速率是逐渐加快,然后又逐渐变慢。从影响反应速率的因素来分析过氧化氢分解速率变化的原因________。