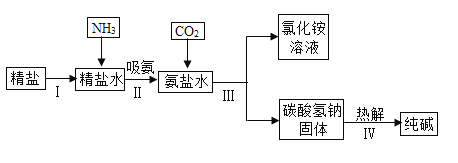
题目内容
【题目】下表为氯化钠和硝酸钾的溶解度:
温度 溶解度/g/100g水 物质 | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 70℃ | 80℃ |
NaCl | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 | 38.4 |
KNO3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 | 169 |
(1)20℃时 KNO3 的溶解度_____(选填“大于”“小 于”)NaCl 的溶解度。随着温度升高,NaCl 的溶解度_____(选填“变大”“变小”或“不变”)。
(2)20℃时,完全溶解 18 g NaCl 恰好得到饱和溶液,所需水的质量是_____g,该溶液质量分数为_____。
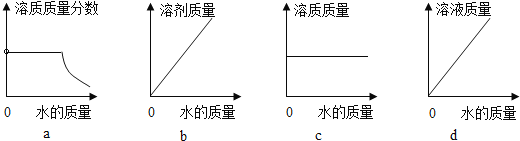
(3)20℃时,向 10 g KNO3 固体不断加水,有关图像正确的是_____(选填编号)。
(4)NaCl中含有少量KNO3提纯NaCl采用的方法是_____(选填“蒸发结晶”或“降温结晶”)。
(5)在最新爆发的 “新型肺炎”疫情的医疗上常用溶质质量分数为0.9%的生理盐水为载体给患者输液。某化学兴趣小组欲配制500g溶质质量分数为0.9%的氯化钠溶液。现有如下操作:①装瓶、贴签;②溶解氯化钠;③秤取氯化钠固体;④量取蒸馏水,正确的操作顺序是_____;在量取水时,俯视刻度线会导致所配制溶液的溶质质量分数_____(填“偏大”、“偏小”或“无影响”)。
【答案】小于 变大 50 26.5% ab 蒸发结晶 ③④②① 偏大
【解析】
(1)由表可知,20℃时KNO3的溶解度为31.6g,氯化钠的溶解度为36g,故20℃时KNO3的溶解度小于NaCl的溶解度;由表可知,随着温度升高,NaCl的溶解度变大;
(2)由表可知,20℃时,氯化钠的溶解度为36g,即该温度下,氯化钠在100g水中达到饱和时,所溶解的质量为36g,故该温度下,完全溶解18gNaCl恰好得到饱和溶液,所需水的质量是50g;该溶液的质量分数是:![]() ;
;
(3)a、20℃时,向 10 g KNO3 固体不断加水,一开始,硝酸钾未完全溶解,溶液为饱和溶液,温度不变,饱和溶液的溶质质量分数不变,待硝酸钾完全溶解后,随着水的加入,溶质质量不变,溶液质量增大,溶质质量分数逐渐减小,符合题意;
b、20℃时,向 10 g KNO3 固体不断加水,随着水的加入,溶液中溶剂的质量不断增大,符合题意;
c、20℃时,向 10 g KNO3 固体不断加水,一开始,溶液中溶质的质量随着硝酸钾的溶解不断增大,待硝酸钾完全溶解后,溶质质量不再变化,不符合题意;
d、当硝酸钾未完全溶解时,随着水的加入,溶液质量逐渐增大,待硝酸钾完全溶解后,随着水的加入,溶液质量逐渐增大,但是增加幅度变小,不符合题意。故选ab;
(4)由表可知,氯化钠、硝酸钾的溶解度都随温度的升高逐渐增加,氯化钠的溶解度受温度影响较小,硝酸钾的溶解度受温度影响较大,故NaCl中含有少量KNO3提纯NaCl采用的方法是:蒸发结晶;
(5)配制一定溶质质量分数的溶液的实验步骤为:计算、称量、量取、溶解、装瓶,故正确的操作顺序是:③④②①;
俯视读数,读取数值大于实际数值,会使量取水的质量偏小,从而导致溶液质量偏小,溶质质量不变,溶液质量偏小,故溶质质量分数偏大。