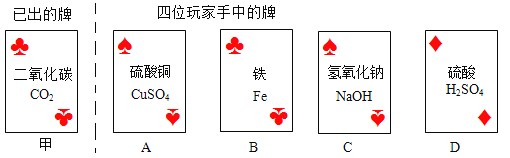
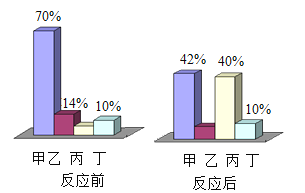
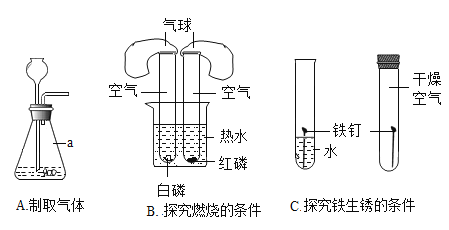
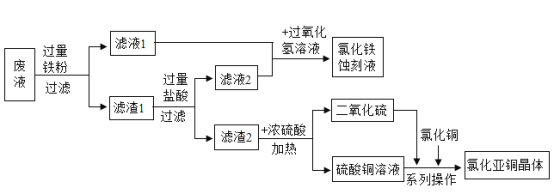
题目内容
【题目】2019年7月28日中国海军“西安舰”参加了俄罗斯海军节庆典海上阅兵。建造西安舰的特种钢材需要用富铁矿石(含铁量高于50%)来冶炼。研学实践小组为测出某地赤铁矿石(主要成分是Fe2O3)中的含铁量,进行实验:取10g赤铁矿石样品,逐渐加入稀硫酸,充分反应后过滤,实验测得相关数据如图所示(假设杂质不溶于水,也不与酸反应)。
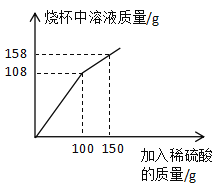
(1)该赤铁矿石样品中铁元素的质量为____g,由此可判断出该赤铁矿石属于富铁矿石。
(2)计算实验中所用稀硫酸中溶质的质量分数(写出计算过程)。
(3)溶质质量分数为10%硫酸铁溶液可用于各种工业废水与城市污水净化处理。实验中恰好完全反应后,过滤,用所得滤液配制溶质质量分数为10%的硫酸铁溶液,需要加水_____g。
【答案】(1)5.6;(2)14.7%;(3)92
【解析】
(1)根据题意,结合图示分析可知,样品中的氧化铁与100g的稀硫酸恰好完全反应,由于氧化铁和酸反应不生成沉淀物或气体,则在化学反应前后,物质的质量相等。则样品中,氧化铁的质量为:108g-100g=8g。故样品中,铁元素的质量为:![]() 。故答案为:5.6;
。故答案为:5.6;
(2)解:设恰好完全反应时消耗的稀硫酸中溶质的质量为x,生成的硫酸铁的质量为y
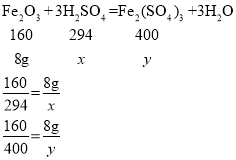
解得x=14.7g,y=20g
则所用稀硫酸中溶质的质量分数为:![]()
答:所用稀硫酸中溶质的质量分数为14.7%。
(3)根据(2)中分析,反应生成的硫酸铁的质量为20g。反应后溶液质量为108g,用所得滤液配制溶质质量分数为10%的硫酸铁溶液,设需要加水的质量为z,则:
![]() ,解得z=92g。即需要加水92g。故答案为:92。
,解得z=92g。即需要加水92g。故答案为:92。

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案【题目】火锅常用的一种燃料是固体酒精。某化学兴趣小组的同学对“固体酒精”成分进行探究。请你回答下列问题:
(查阅资料)
a 固体酒精是用酒精、氯化钙和氢氧化钠按一定的质量比混合制成的。
b 氯化钙、氯化钡溶液均呈中性。
(提出问题)
(1)酒精中是否含有碳元素?
(2)固体酒精中的氢氧化钠是否变质?
(实验探究)
(1)按如图所示进行实验,发现烧杯内壁有一层白膜,可得出酒精中含有_______________元素;
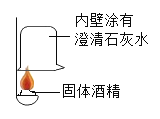
(2)取少量固体酒精于烧杯中,加足量的水充分溶解后静置,观察到____现象,由此说明氢氧化钠已变质。氢氧化钠变质的化学方程式为__________;
(3)为进一步确定氢氧化钠的变质程度,分组进行探究。
甲组同学取烧杯上层清液于两支试管中,按下列方案进行实验。
实验操作 | 实验现象 | 实验结论 |
向一支试管中滴加酚酞溶液 | 溶液变红 | 清液中有氢氧化钠 |
向另一支试管中滴加澄清石灰水 | 产生白色沉淀 | 清液中有____ |
乙组同学认为甲组实验不能证明清液中一定有氢氧化钠,理由是____;
他们另取烧杯中的上层清液,加足量氯化钡溶液,充分反应后,静置,取上层清液,滴加酚酞溶液,酚酞溶液变红。
(反思与交流)乙组实验中加足量氯化钡溶液的目的是__________________;
(实验结论]小组同学经过讨论,一致认为该固体酒精中的氢氧化钠部分变质。