题目内容
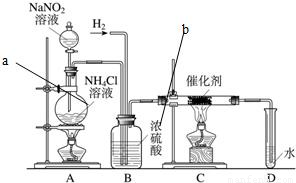
亚硝酸钠是实验室常用的试剂,实验室一般用亚硝酸钠溶液与氯化铵溶液反应来制取N2.N2的化学性质十分稳定,但在一定条件下能与H2部分化合生成NH3.下图为制取少量NH3的装置(制取H2的装置已略去):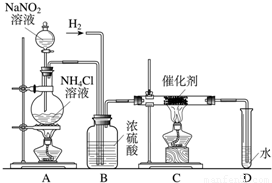
(1)C装置的硬质试管中发生反应的化学方程式为______△2NH3
【答案】分析:(1)、根据题干信息可知:反应物是NaNO2和NH4Cl,生成物是N2和H20,结合质量守恒定律可知:生成物还有NaCl,然后氮气与氢气在C处发生反应生成氨气,注意反应条件.
(2)、物质的质量之比等于相对分子质量和的比,从题干中氮气与氢气部分化合可知最后导出的气体中含有氮气与氢气.
(3、依据浓硫酸吸水性分析即可.
(4、检验氨气的方法,是采用氨水呈碱性,结合酚酞检验即可.
解答:解:(1)根据质量守恒定律及题干信息可知,反应物是NaNO2和NH4Cl,生成物是N2和H20和NaCl,方程是NaNO2+NH4Cl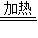 N2↑+2H20+NaCl;氮气与氢气在C处发生反应生成氨气N2+3H2
N2↑+2H20+NaCl;氮气与氢气在C处发生反应生成氨气N2+3H2 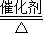 2NH3
2NH3
(2)利用化学方程式的物质的质量比等于相对原子质量和的比找到两物质的最佳质量比,
N2 +3H2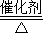 2NH3
2NH3
14×2 6
所以氮气与氢气的质量之比是14:3时最为合适.
知最后导出的气体中含有氮气与氢气,所以氨气溶于水后好会有气体放出.
(4)因为制取氮气时伴随有水蒸汽的生成,故硫酸的作用为干燥,
(5)这是氨气的检验方法,因为氨气的水溶液显碱性,所以加入酚酞变红.
故答案为:(1)3 H2+N2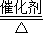 2 NH3(2)14:3; 因为是“部分化合”,仍会有未反应的H2和N2逸出(3)干燥
2 NH3(2)14:3; 因为是“部分化合”,仍会有未反应的H2和N2逸出(3)干燥
(4)向D中滴入无色酚酞溶液,酚酞变红.
点评:这个题考查氢气的实验室制法、氨气的检验、浓硫酸的性质等内容,利用所学知识对知识进行迁移即可解决问题.
(2)、物质的质量之比等于相对分子质量和的比,从题干中氮气与氢气部分化合可知最后导出的气体中含有氮气与氢气.
(3、依据浓硫酸吸水性分析即可.
(4、检验氨气的方法,是采用氨水呈碱性,结合酚酞检验即可.
解答:解:(1)根据质量守恒定律及题干信息可知,反应物是NaNO2和NH4Cl,生成物是N2和H20和NaCl,方程是NaNO2+NH4Cl
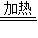 N2↑+2H20+NaCl;氮气与氢气在C处发生反应生成氨气N2+3H2
N2↑+2H20+NaCl;氮气与氢气在C处发生反应生成氨气N2+3H2  2NH3
2NH3(2)利用化学方程式的物质的质量比等于相对原子质量和的比找到两物质的最佳质量比,
N2 +3H2
 2NH3
2NH314×2 6
所以氮气与氢气的质量之比是14:3时最为合适.
知最后导出的气体中含有氮气与氢气,所以氨气溶于水后好会有气体放出.
(4)因为制取氮气时伴随有水蒸汽的生成,故硫酸的作用为干燥,
(5)这是氨气的检验方法,因为氨气的水溶液显碱性,所以加入酚酞变红.
故答案为:(1)3 H2+N2
 2 NH3(2)14:3; 因为是“部分化合”,仍会有未反应的H2和N2逸出(3)干燥
2 NH3(2)14:3; 因为是“部分化合”,仍会有未反应的H2和N2逸出(3)干燥(4)向D中滴入无色酚酞溶液,酚酞变红.
点评:这个题考查氢气的实验室制法、氨气的检验、浓硫酸的性质等内容,利用所学知识对知识进行迁移即可解决问题.

练习册系列答案
相关题目
 亚硝酸钠是实验室常用的试剂,实验室一般用亚硝酸钠溶液与氯化铵溶液反应来制取N2.N2的化学性质十分稳定,但在一定条件下能与H2部分化合生成NH3.下图为制取少量NH3的装置(制取H2的装置已略去):
亚硝酸钠是实验室常用的试剂,实验室一般用亚硝酸钠溶液与氯化铵溶液反应来制取N2.N2的化学性质十分稳定,但在一定条件下能与H2部分化合生成NH3.下图为制取少量NH3的装置(制取H2的装置已略去):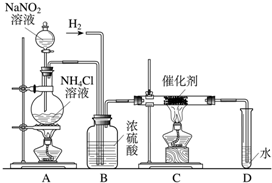
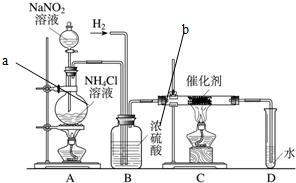 亚硝酸钠是实验室常用的试剂,实验室一般用亚硝酸钠溶液与氯化铵溶液反应来制取N2.N2的化学性质十分稳定,但在一定条件下能与H2部分化合生成NH3.下图为制取少量NH3的装置(制取H2的装置已略去):
亚硝酸钠是实验室常用的试剂,实验室一般用亚硝酸钠溶液与氯化铵溶液反应来制取N2.N2的化学性质十分稳定,但在一定条件下能与H2部分化合生成NH3.下图为制取少量NH3的装置(制取H2的装置已略去):