题目内容
(6 分)镁是一种用途广泛的金属材料,目前大部分镁都是利用从海水中提取的镁盐 制取的。某校化学活动小组欲测定海水中氯化镁的含量,取海水样品 200g,加入适量 氢氧化钠溶液,至恰好完全反应为止,称量所得沉淀物的质量为 0.58g。 请你根据上述资料,回答下列问题:
⑴金属镁的物理性质有: 。(答出一条即可)
⑵查阅资料可知,海水中镁元素的含量比较低,所以,从海水中提取 MgCl2 时, 经历了“MgCl2 → Mg(OH)2 → MgCl2”的转化过程,请分析这样做的目的是
⑶列式计算:上述 200g 海水样品中,所含 MgCl2 的质量是多少?
(提示:MgCl2 + 2NaOH = Mg(OH)2↓ + 2NaCl )
⑴金属镁的物理性质有: 。(答出一条即可)
⑵查阅资料可知,海水中镁元素的含量比较低,所以,从海水中提取 MgCl2 时, 经历了“MgCl2 → Mg(OH)2 → MgCl2”的转化过程,请分析这样做的目的是
⑶列式计算:上述 200g 海水样品中,所含 MgCl2 的质量是多少?
(提示:MgCl2 + 2NaOH = Mg(OH)2↓ + 2NaCl )
⑴ 银白色固体/ 良好延展性、传导性/ 密度、硬度均较小/ 熔沸点较高 等
⑵ 采用化学沉淀法将海水中的镁元素予以富集、提取分离
⑵ 采用化学沉淀法将海水中的镁元素予以富集、提取分离
试题分析:利用化学方程式氯化镁与氢氧化镁反应的质量比即可计算出氯化镁的质量。
⑶解:设海水样品中MgCl2的质量为x,则
MgCl2 + 2NaOH = Mg(OH)2↓+ 2NaCl
95 58
x 0.58g
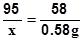 , 得 x = 0.95g
, 得 x = 0.95g 答:该海水样品中含有0.95gMgCl2。

练习册系列答案
 小题狂做系列答案
小题狂做系列答案
相关题目