题目内容
小华是个非常爱动脑的同学,做溶液的导电性实验时,小华观察得非常仔细,以下是他们小组观察、记录并思考的一些问题:(1)电解水时,通常要加入少量氢氧化钠溶液或稀硫酸,目的是______.
(2)经过溶液的学习后,小华明白了不是所有的溶液都能导电的道理,下列物质加入水中充分振荡后能导电的是______
A.蔗糖 B.植物油 C.高锰酸钾 D.碳酸钠
(3)溶液能否导电是由溶质在溶剂中分散的微粒不同而决定的,能导电的溶液是因为这些溶液中溶质以______(填“分子”或“离子”)形式分散,这类物质在溶剂中的分散过程可简捷地用电离方程式来表示,如硫酸在水中的分散过程可简捷地用电离方程式H2SO4═2H++SO42-米表示,那么氢氧化钠在水中的电离方程式可表示为______.
(4)若某氢氧化钠溶液中钠离子和水分子的个数比为1:20,则该溶液中溶质的质量分数为:______.(不要求计算过程)
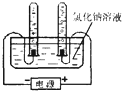
(5)做氯化钠溶液的导电性实验时,小华不仅看到灯泡亮了,还观察到与电解水相似的现象:两根石墨电极上都出现了气泡.这激发了小华探究气泡成分的欲望.请你一起参与小华的探究活动吧!
【提出问题】氯化钠溶液通电时石墨电极上分别生成了什么气体?
【查阅资料】Cl2是黄绿色、有刺激性气味的有毒气体,常温下1体积水能溶解2体积Cl2.
【提出假设】假设1:电极上分别生成了氢气和氯气;
假设2:电极上分别生成了氧气和氯气;
假设3:电极上分别生成了氢气和氧气.以上假设的依据是______.
【设计实验】小红决定用电解水的装置重做氯化钠溶液的导电性实验.
【进行实验】用如图所示的实验分别收集氯化钠溶液通电
时两个电极上产生的气体.
【收集证据】观察气体颜色,刚燃着的木条检验收集到的无色气体,
发现氯化钠溶液在通电条件下产生了两种气体.
【实验分析】若一支试管中收集剑的气体为黄绿色,另一支试管中收集到的气体能支持燃烧,则假设______成立:若两支试管内收集到了两种不同的无色气体,则发生反应的化学方程式为______ 2H2↑+O2↑

【答案】分析:(1)电解水时,通常要加入少量氢氧化钠溶液或稀硫酸,目的是增强水的导电性;
(2)根据溶液导电的原理是有自由移动离子进行解答;
(3)根据溶液导电的原理是有自由移动离子以及氢氧化钠在水中的电离出钠离子和氢氧根离子进行解答;
(4)根据氢氧化钠溶液中钠离子和水分子的个数比为1:20,求出氢氧化钠和水的质量比从而求出溶液中溶质的质量分数进行解答;
(5)【提出假设】根据质量守恒定律来解答;
[实验分析]氧气不能燃烧,氢气可以燃烧,氯气为黄绿色的气体;
【反思评价】氯化钠能够分解产生气体,会干扰实验现象;
解答:解:(1)电解水时,通常要加入少量氢氧化钠溶液或稀硫酸,目的是增强水的导电性;
(2)只有自由移动的带电离子才可能导电,所以能够在水中电离产生阴阳离子的物质有高锰酸钾和碳酸钠,所以水中充分振荡后能导电的是高锰酸钾和碳酸钠;
(3)溶液导电的原理是有自由移动离子,所以能导电的溶液是因为这些溶液中溶质以离子形式分散;氢氧化钠在水中的电离出钠离子和氢氧根离子,电离方程式可表示为NaOH=Na++OH-;
(4)氢氧化钠溶液中钠离子和水分子的个数比为1:20,所以氢氧化钠和水的质量比为40:18×20,溶液中溶质的质量分数=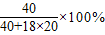 =10%;
=10%;
(5)[提出假设]根据氯化钠溶液中含有的离子,结合质量守恒定律而做出的推断;
[实验分析]若观察到一支试管中收集的气体为黄绿色,另一支试管中收集到的气体能被点燃,则说明该气体为氯气和氢气,及假设1正确;加入酚酞变红说明含有氢氧化钠,可以得出的答案;
[反思评价]氯化钠能够分解产生氢气和氯气,会干扰实验现象,所以不能加入氯化钠;
故答案为:(1)增强水的导电性;
(2)CD;
(3)离子;NaOH=Na++OH-;
(4)10%;
(5)【提出假设】化学反应前后元素的种类不变;
【实验分析】1;2H2O 2H2↑+O2↑;
2H2↑+O2↑;
2NaCl+2H2O 2NaOH+H2↑+Cl2↑;
2NaOH+H2↑+Cl2↑;
【反思与评价】不可以;产生气体中含有氯气.
点评:知道电解水实验的产物,及实验过程中的注意事项,加入氢氧化钠或是硫酸能够增强导电性,加速分解.能够根据实验现象结合质量守恒定律来书写化学方程式.
(2)根据溶液导电的原理是有自由移动离子进行解答;
(3)根据溶液导电的原理是有自由移动离子以及氢氧化钠在水中的电离出钠离子和氢氧根离子进行解答;
(4)根据氢氧化钠溶液中钠离子和水分子的个数比为1:20,求出氢氧化钠和水的质量比从而求出溶液中溶质的质量分数进行解答;
(5)【提出假设】根据质量守恒定律来解答;
[实验分析]氧气不能燃烧,氢气可以燃烧,氯气为黄绿色的气体;
【反思评价】氯化钠能够分解产生气体,会干扰实验现象;
解答:解:(1)电解水时,通常要加入少量氢氧化钠溶液或稀硫酸,目的是增强水的导电性;
(2)只有自由移动的带电离子才可能导电,所以能够在水中电离产生阴阳离子的物质有高锰酸钾和碳酸钠,所以水中充分振荡后能导电的是高锰酸钾和碳酸钠;
(3)溶液导电的原理是有自由移动离子,所以能导电的溶液是因为这些溶液中溶质以离子形式分散;氢氧化钠在水中的电离出钠离子和氢氧根离子,电离方程式可表示为NaOH=Na++OH-;
(4)氢氧化钠溶液中钠离子和水分子的个数比为1:20,所以氢氧化钠和水的质量比为40:18×20,溶液中溶质的质量分数=
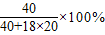 =10%;
=10%;(5)[提出假设]根据氯化钠溶液中含有的离子,结合质量守恒定律而做出的推断;
[实验分析]若观察到一支试管中收集的气体为黄绿色,另一支试管中收集到的气体能被点燃,则说明该气体为氯气和氢气,及假设1正确;加入酚酞变红说明含有氢氧化钠,可以得出的答案;
[反思评价]氯化钠能够分解产生氢气和氯气,会干扰实验现象,所以不能加入氯化钠;
故答案为:(1)增强水的导电性;
(2)CD;
(3)离子;NaOH=Na++OH-;
(4)10%;
(5)【提出假设】化学反应前后元素的种类不变;
【实验分析】1;2H2O
 2H2↑+O2↑;
2H2↑+O2↑;2NaCl+2H2O
 2NaOH+H2↑+Cl2↑;
2NaOH+H2↑+Cl2↑;【反思与评价】不可以;产生气体中含有氯气.
点评:知道电解水实验的产物,及实验过程中的注意事项,加入氢氧化钠或是硫酸能够增强导电性,加速分解.能够根据实验现象结合质量守恒定律来书写化学方程式.

练习册系列答案
相关题目
 小华是个非常爱动脑的同学,做溶液的导电性实验时,小华观察得非常仔细,以下是他们小组观察、记录并思考的一些问题:
小华是个非常爱动脑的同学,做溶液的导电性实验时,小华观察得非常仔细,以下是他们小组观察、记录并思考的一些问题: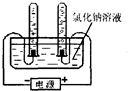 29、小华是个非常爱动脑的同学,做溶液的导电性实验时,小华观察得非常仔细,以下是他们小组观察、记录并思考的一些问题:
29、小华是个非常爱动脑的同学,做溶液的导电性实验时,小华观察得非常仔细,以下是他们小组观察、记录并思考的一些问题:
 小华是个非常爱动脑的同学,做溶液的导电性实验时,小华观察得非常仔细,以下是他们小组观察、记录并思考的一些问题:
小华是个非常爱动脑的同学,做溶液的导电性实验时,小华观察得非常仔细,以下是他们小组观察、记录并思考的一些问题: 小华是个非常爱动脑的同学,做溶液的导电性实验时,小华观察得非常仔细,以下是他们小组观察、记录并思考的一些问题:
小华是个非常爱动脑的同学,做溶液的导电性实验时,小华观察得非常仔细,以下是他们小组观察、记录并思考的一些问题: