题目内容
 29、小华是个非常爱动脑的同学,做溶液的导电性实验时,小华观察得非常仔细,以下是他们小组观察、记录并思考的一些问题:
29、小华是个非常爱动脑的同学,做溶液的导电性实验时,小华观察得非常仔细,以下是他们小组观察、记录并思考的一些问题:(1)电解水时,通常要加入少量氢氧化钠溶液或稀硫酸,目的是
增强溶液的导电性
.(2)经过溶液的学习后,小华明白了不是所有的溶液都能导电的道理,下列物质加入水中充分振荡后能导电的是
CD
.A.蔗糖 B.植物油 C.高锰酸钾 D.碳酸钠
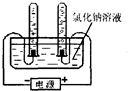
(3)做氯化钠溶液的导电性实验时,小华不仅看到灯泡亮了,还观察到与电解水相似的现象:两根石墨电极上都出现了气泡.这激发了小华探究气泡成分的欲望.请你一起参与小华的探究活动吧!
[提出问题]氯化钠溶液通电时石墨电极上分别生成了什么气体?
[查阅资料]Cl2是黄绿色、有刺激性气味的有毒气体,常温下1体积水能溶解2体积Cl2.
[提出假设]假设1:电极上分别生成了氢气和氯气;
假设2:电极上分别生成了氧气和氯气;
假设3:电极上分别生成了氢气和氧气.以上假设的依据是
质量守恒定律,化学反应前后,元素种类不变
.[设计实验]小华决定用右图所示的装置来电解氯化钠的饱和溶液.并收集两个电极上产生的气体.
[实验分析]观察到一支试管中收集的气体为黄绿色,另一支试管中收集到的气体能被点燃,则假设
1
成立:小红又向反应后的溶液中滴加无色酚酞,结果酚酞变红,请写出氯化钠溶液通电时发生反应的化学方程式_2NaCl+2H2O═2NaOH+H2↑+Cl2↑
.[反思与评价]联想电解水的实验,你认为在电解水时
不可以
(填“可以”或“不可以”)加入少量的氯化钠溶液,原因是氯化钠参与反应,影响实验
.(4)小华还想利用H2还原氧化铁的实验测定水中氢、氧两种元素的质量比.
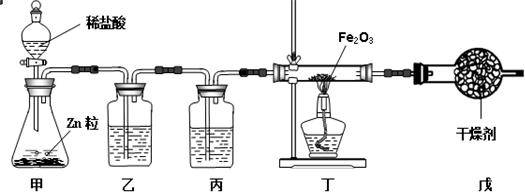
[设计实验]实验装置图如下:
①写出装置中试剂的名称:乙
②氢氧化钠溶液
,丙浓硫酸
.②实验开始时,应该先
b
(选填字母).a.加热反应管丁 b.从分液漏斗中滴加液体
在这两步操作之间,还应进行的一步操作是
检查氢气纯度
.③写出反应管丁中发生反应的化学方程式:
3H2+Fe2O3═2Fe+3H2O
.[进行实验]该小组同学进行了实验,测得了下列数据:
| 反应前 | 反应后 | |
| 丁管和内盛物的总质量 | 132.4g | 130.0g(冷却到室温称量) |
| 戊管及内盛物的总质量 | 143.2g | 145.9g |
mO=2.4g,mH=2.7g-2.4g=0.3g,mH:mO=1:8
[误差分析]
①如果该实验缺少装置丙,则测得的水中氢、氧两种元素的质量比会
偏大
(选填“偏大”或“偏小”).②如果实验后观察到反应管丁中有水珠凝结,则测得的水中氢、氧两种元素的质量比会
偏大
(选填“偏大”或“偏小”).分析:(1)加入氢氧化钠或硫酸,可以增强水的导电能力,加速分解;
(2)只有自由移动的带电离子才可能导电;
(3)【提出假设】根据质量守恒定律来解答;
[实验分析]氧气不能燃烧,氢气可以燃烧,氯气为黄绿色的气体;
【反思评价】氯化钠能够分解产生气体,会干扰实验现象;
(4)[设计实验]①根据实验目的来填空;
②根据仪器的特点来解答;
③可以直接写出反应的化学方程式;
[数据处理]根据质量比等于相对原子质量的和的比;
[误差分析]①产生氢气的会带出一步水蒸气,
②根据氢氧元素的质量比的求法可以得出该题的答案.
(2)只有自由移动的带电离子才可能导电;
(3)【提出假设】根据质量守恒定律来解答;
[实验分析]氧气不能燃烧,氢气可以燃烧,氯气为黄绿色的气体;
【反思评价】氯化钠能够分解产生气体,会干扰实验现象;
(4)[设计实验]①根据实验目的来填空;
②根据仪器的特点来解答;
③可以直接写出反应的化学方程式;
[数据处理]根据质量比等于相对原子质量的和的比;
[误差分析]①产生氢气的会带出一步水蒸气,
②根据氢氧元素的质量比的求法可以得出该题的答案.
解答:解:(1)在水中加入加入氢氧化钠或硫酸,可以增强水的导电能力;
(2)只有自由移动的带电离子才可能导电,所以能够在水中电离产生阴阳离子的物质有高锰酸钾和碳酸钠
(3)[提出假设]根据氯化钠溶液中含有的离子,结合质量守恒定律而做出的推断;
[实验分析]若观察到一支试管中收集的气体为黄绿色,另一支试管中收集到的气体能被点燃,则说明该气体为氯气和氢气,及假设1正确;加入酚酞变红说明含有氢氧化钠,可以得出的答案;
[反思评价]氯化钠能够分解产生氢气和氯气,会干扰实验现象,所以不能加入氯化钠;
(4)[设计实验]①考虑到盐酸中含有氯化氢,所以应该在乙装置中加入碱液来吸收氯化氢,常用的为氢氧化钠溶液,当气体从氯化钠溶液中通过时会带出一部分水蒸气,故应该在丙装置中加入浓硫酸来干燥气体;
②由于在装置中存在着空气,所以应该先通入气体然后再来加热,
③氢气具有可燃性,必须确保其纯度,故应该先检验氢气的纯度;
[数据处理]根据丁装置中固体的质量减少可以知道氧元素的质量,根据戊管中的质量的增加可以知道是水的质量,而水是由氢氧元素组成的,故可以求出氢元素的质量,即可求出其质量比;
[误差分析]①丙装置为吸收水的装置,如果该实验缺少装置丙,则测得的水中氢、氧两种元素的质量比会偏大;
②丁中有水珠凝结,则导致丁管的质量减少的少了,所以会使氧元素的质量减少而氢元素的质量增大,而使氢氧元素的质量比增大.
故答案为:(1)增强溶液的导电性;
(2)CD;
(3)[提出假设]质量守恒定律,化学反应前后,元素种类不变;
[实验分析]1;2NaCl+2H2O═2NaOH+H2+Cl2;
[反思与评价]不可以;氯化钠参与反应,影响实验;
(4)[设计实验]①氢氧化钠溶液;浓硫酸;
②b;检查氢气纯度;
③3H2+Fe2O3═2Fe+3H2O;
[数据处理]Mo=2.4g,MH=2.7g-2.4g=0.3g,MH:Mo=1:8
[误差分析]偏大;偏大.
(2)只有自由移动的带电离子才可能导电,所以能够在水中电离产生阴阳离子的物质有高锰酸钾和碳酸钠
(3)[提出假设]根据氯化钠溶液中含有的离子,结合质量守恒定律而做出的推断;
[实验分析]若观察到一支试管中收集的气体为黄绿色,另一支试管中收集到的气体能被点燃,则说明该气体为氯气和氢气,及假设1正确;加入酚酞变红说明含有氢氧化钠,可以得出的答案;
[反思评价]氯化钠能够分解产生氢气和氯气,会干扰实验现象,所以不能加入氯化钠;
(4)[设计实验]①考虑到盐酸中含有氯化氢,所以应该在乙装置中加入碱液来吸收氯化氢,常用的为氢氧化钠溶液,当气体从氯化钠溶液中通过时会带出一部分水蒸气,故应该在丙装置中加入浓硫酸来干燥气体;
②由于在装置中存在着空气,所以应该先通入气体然后再来加热,
③氢气具有可燃性,必须确保其纯度,故应该先检验氢气的纯度;
[数据处理]根据丁装置中固体的质量减少可以知道氧元素的质量,根据戊管中的质量的增加可以知道是水的质量,而水是由氢氧元素组成的,故可以求出氢元素的质量,即可求出其质量比;
[误差分析]①丙装置为吸收水的装置,如果该实验缺少装置丙,则测得的水中氢、氧两种元素的质量比会偏大;
②丁中有水珠凝结,则导致丁管的质量减少的少了,所以会使氧元素的质量减少而氢元素的质量增大,而使氢氧元素的质量比增大.
故答案为:(1)增强溶液的导电性;
(2)CD;
(3)[提出假设]质量守恒定律,化学反应前后,元素种类不变;
[实验分析]1;2NaCl+2H2O═2NaOH+H2+Cl2;
[反思与评价]不可以;氯化钠参与反应,影响实验;
(4)[设计实验]①氢氧化钠溶液;浓硫酸;
②b;检查氢气纯度;
③3H2+Fe2O3═2Fe+3H2O;
[数据处理]Mo=2.4g,MH=2.7g-2.4g=0.3g,MH:Mo=1:8
[误差分析]偏大;偏大.
点评:知道电解水实验的产物,及实验过程中的注意事项,加入氢氧化钠或是硫酸能够增强导电性,加速分解.能够根据实验现象结合质量守恒定律来书写化学方程式.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
 小华是个非常爱动脑的同学,做溶液的导电性实验时,小华观察得非常仔细,以下是他们小组观察、记录并思考的一些问题:
小华是个非常爱动脑的同学,做溶液的导电性实验时,小华观察得非常仔细,以下是他们小组观察、记录并思考的一些问题: 小华是个非常爱动脑的同学,做溶液的导电性实验时,小华观察得非常仔细,以下是他们小组观察、记录并思考的一些问题:
小华是个非常爱动脑的同学,做溶液的导电性实验时,小华观察得非常仔细,以下是他们小组观察、记录并思考的一些问题: 小华是个非常爱动脑的同学,做溶液的导电性实验时,小华观察得非常仔细,以下是他们小组观察、记录并思考的一些问题:
小华是个非常爱动脑的同学,做溶液的导电性实验时,小华观察得非常仔细,以下是他们小组观察、记录并思考的一些问题: