题目内容
【题目】某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究,请你参与他们的研究过程.
(查阅资料:氮气不与碳、氧化铁发生反应)
(1)【提出假设】①该反应的气体产物是CO2
②该反应的气体产物是CO
③该反应的气体产物是;
(2)【设计实验】如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应。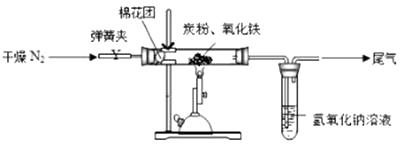
【实验步骤】
①按上图连接装置,并检查装置的气密性.称取3.20g、2.00g碳粉混合均匀,放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热;
④待反应结束,再缓缓通入一段时间的氮气.冷却至室温,称得硬质玻璃管和固体总质量为52.24g;
⑤测得盛有氢氧化钠溶液的试管较反应前增加了0.88g.
步骤②中通入N2的作用是;步骤④中通入N2的作用是 .
(3)【数据处理】根据实验数据分析,写出该实验中氧化铁与碳发生反应的化学方程式:;
(4)【问题讨论】
①用氢氧化钠溶液作为吸收试剂,而不用澄清石灰水的原因是 .
②从环境保护的角度,请你提出一个实验中需要改进的措施 .
【答案】
(1)CO2和CO
(2)排尽装置中的空气,使生成的二氧化碳全部氢氧化钠溶液吸收
(3)Fe2O3+2C ![]() 2Fe+CO2↑+CO↑
2Fe+CO2↑+CO↑
(4)氢氧化钙的溶解度较小,不能吸收较多的二氧化碳,点燃或收集尾气
【解析】解:【提出假设】碳还原氧化铁生成铁和二氧化碳,由于碳能与二氧化碳分数还原反应生成一氧化碳,故生成的气体可能是二氧化碳,也可能是一氧化碳,还可能是一氧化碳和二氧化碳的混合物;
【实验步骤】先通氮气的目的是将置换中的空气排尽;该实验用了氢氧化钠吸收生成的二氧化碳,根据溶液的质量的变化计算生成的二氧化碳的质量,故反应后继续通氮气的目的是使生成的二氧化碳全部氢氧化钠溶液吸收,使实验结果更准确;
【数据处理】反应前总质量=3.20g+2.00g+48.48g=53.68g,反应后总质量为52.24g,
减少的质量=53.68g-52.24g=1.44g ,减少的质量即为生成的气体的质量;测得盛有氢氧化钠溶液的试管较反应前增加了0.88g,即生成的二氧化碳的质量为0.88g,故还生成了一氧化碳。反应的化学方程式表示为:Fe2O3+2C ![]() 2Fe+CO2↑+CO↑;
2Fe+CO2↑+CO↑;
【问题讨论】①氢氧化钙的溶解度较小,不能吸收较多的二氧化碳;②该反应中生成了一氧化碳,一氧化碳有毒,会污染空气,故要有尾气处理装置。
所以答案是:(1)CO2和CO;(2)排尽装置中的空气;使生成的二氧化碳全部氢氧化钠溶液吸收;(3)Fe2O3+2C![]() 2Fe+CO2↑+CO↑;(4)氢氧化钙的溶解度较小,不能吸收较多的二氧化碳;点燃或收集尾气。
2Fe+CO2↑+CO↑;(4)氢氧化钙的溶解度较小,不能吸收较多的二氧化碳;点燃或收集尾气。
【考点精析】解答此题的关键在于理解一氧化碳的毒性的相关知识,掌握有毒:吸进肺里与血液中的血红蛋白结合,使人体缺少氧气而中毒,以及对质量守恒定律及其应用的理解,了解①质量守恒定律只适用于化学变化,不适用于物理变化;②不参加反应的物质质量及不是生成物的物质质量不能计入“总和”中;③要考虑空气中的物质是否参加反应或物质(如气体)有无遗漏.