题目内容
【题目】某化学兴趣小组对金属的性质做了如下探究,请你填写空格:
(1)用下图所示实验探究铁生锈的条件(每支试管中均放有完全相同的洁净铁片):
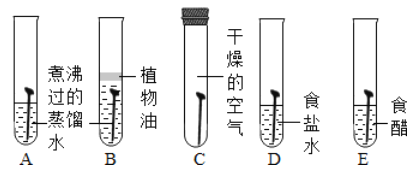
①甲同学认为,试管A发生的现象就能够说明铁的锈蚀是铁与空气中的氧气、水蒸气共同作用的结果。乙同学不同意他的观点,认为必须全面观察试管___________(选填试管编号)发生的现象,并经过科学严谨的推理,才能得出上述结论。
②试管D和E实验的目的是进一步探究铁在___________________的环境中是否更容易锈蚀。
③为防止金属锈蚀,除了采用覆盖保护膜等措施以外,还可以制成合金。这是因为合金与纯金属相比,其组成和内部组织结构发生变化,从而引起___________的变化。
(2)某同学向分别盛有等质量的铁粉和锌粒的试管中,倒入等质量、等溶质质量分数的稀硫酸,以“金属表面产生气泡的快慢”为标准来判断两种金属的活动性强弱。有的同学认为这种方案不够合理,理由是____________________________________________。
(3)将一定质量的铁粉放入硝酸铜、硝酸锌的混合溶液中,充分反应后过滤,所得固体中一定含有的物质是___________,且反应后溶液质量比反应前___________(选填“增大”“减小”或“不变”)。
【答案】 ABC 盐、酸存在 性质 没控制相同条件,金属的表面积不同 铜 减小
【解析】(1)①要证明铁的锈蚀是铁与空气中的氧气、水蒸气共同作用的结果,就要看铁分别在隔绝空气、隔绝水的条件下,和暴露在有水和空气的条件下的不同,得出结论。所以必须全面观察试管ABC发生的现象,并经过科学严谨的推理,才能得出上述结论;
②试管D和E实验的目的是进一步探究铁在盐、酸存在的环境中铁的锈蚀情况;
③金属的组成和内部组织结构发生变化,其性质等就会发生变化;
(2)金属的颗粒大小不同,与酸的反应速度也不同,所以没控制相同的条件,颗粒大小不同,金属表面产生气泡的快慢,也会受到影响;
(3)三种金属活动性由强到弱的顺序:锌>铁>铜,可知铁只能置换出铜,根据铁与硝酸铜反应的方程式:Fe+Cu(NO3)2═Cu+Fe(NO3)2。可知56份质量的铁可以置换出64份质量的铜,所以反应后溶液质量比反应前减小。