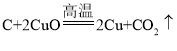题目内容
【题目】(1)橡胶属于_________材料,玻璃钢属于_________材料(选填“金属”、“合成”、“复合”);
(2)生铁的含碳量__________________
(3)科学家用NaOH溶液喷淋吸收CO2.下列叙述正确的是_______.
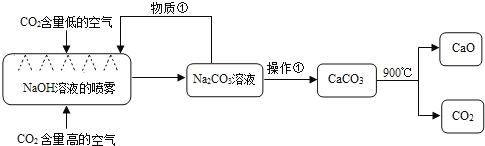
A该方法中包含分解反应,置换反应等
B物质①是Na2CO3溶液
C操作①是蒸发浓缩,降温结晶
D整个过程至少有两种物质可以循环利用.
(4)A. B.C三种固体物质的溶解度曲线图(A. B.C析出晶体时均不含结晶水),根据曲线图回答下列问题。(如图横坐标从左到右依次为t1℃、t2℃、t3℃)
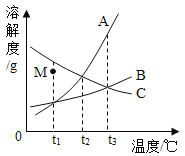
①若将M点处C的不饱和溶液变成饱和溶液,可以选择的方法是______(填序号).
A降低温度 B 增加溶质 C蒸发溶剂
②t2℃时,将等质量的A. B. C的饱和溶液都升温到t3℃, 溶液中溶剂质量的大小关系是(忽略水的挥发)_____________.
【答案】合成 复合 2%--4.3% D BC A=C<B
【解析】
根据流程和溶解度曲线以及影响溶解的因素。
(1)橡胶属于合成材料,玻璃钢属于复合材料;
(2)生铁含碳量一般在2%--4.3%,钢的含碳量0.03%-2%,故生铁的含碳量为2%--4.3%;
(3)从流程中可知Na2CO3可与Ca(OH)2发生复分解反应得CaCO3和NaOH,且NaOH可循环使用,要分离CaCO3应该可采用过滤来实现,故物质①是NaOH溶液,操作①是过滤;CaCO3生成CaO和CO2为分解反应,且CO2可循环使用。
A、置换反应为单质与化合物反应生成新的单质和新的化合物,该方法中没有单质出现,故不可能有置换反应存在,A选项不正确;
B、物质①应该是NaOH溶液,B选项不正确;
C、操作①为分离CaCO3和NaOH溶液,应该用过滤,故C选项不正确;
D、整个过程中NaOH溶液和CO2可循环使用,故D选项正确;
故选D。
(4)C的溶解度随温度升高而降低,故其不饱和溶液变为饱和溶液的方法有升高温度、加溶质、蒸发溶剂三种方法;故①若将M点处C的不饱和溶液变成饱和溶液,可以选择的方法是B. 增加溶质和C. 蒸发溶剂;
②t2℃时,三种物质溶解度大小有关系为A=C>B,故t2℃时等质量的A. B. C的饱和溶液中溶质质量关系为A=C>B则溶剂质量大小关系与之相反为A=C<B,当都升温到t3℃时,只是温度变化时溶剂质量不变,故三者溶剂质量大小关系为A=C<B。

 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案【题目】为了探究中和反应,甲、乙两名同学分别向下列两支试管中滴加稀盐酸。
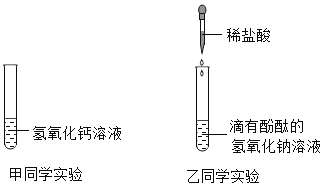
(1)乙同学向滴有酚酞的氢氧化钠溶液中逐渐加入稀盐酸,边滴加边振荡,乙同学意外发现有气泡产生,说明该氢氧化钠溶液已变质,变质的原因_________________________________ (用化学方程式表示).
(2)乙同学为了检验该氢氧化钠溶液的变质程度,设计实验方案并得出结论。
实验操作 | 实验现象 | 实验结论 |
取样少许于试管中,先滴加_________,再滴加_________ | ____________ | 氢氧化钠溶液部分变质 |
(3)实验结束后,甲、乙同学将他们两人试管中的废液倒入同一洁净烧杯中,得到无色澄清溶液,分析所得溶液中溶质的成分为①_______________,②_____________________(不考虑酚酞)。
(4)丙同学要除去部分变质的氢氧化钠溶液中的杂质,可选择适量的_________.
A. 氢氧化钡溶液 B. 硝酸钡溶液 C. 氢氧化钙溶液 D. 氯化钠溶液。
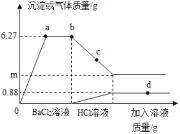
【题目】为了测定某硫酸钠和氯化钠样品中硫酸钠的纯度,取200g样品,分别在5只烧杯中进行实验,实验数据如下(杂质不溶于水,也不和稀盐酸反应)
烧杯1 | 烧杯2 | 烧杯3 | 烧杯4 | 烧杯5 | |
加入样品的质量g | 40 | 40 | 40 | 40 | 40 |
加入氯化钡溶液的质量g | 50 | 100 | 150 | 200 | 250 |
充分反应后生成沉淀的质量g | 11.65 | 23.3 | 34.95 | 46.6 | 46.6 |
(1)烧杯________(填序号)中的物质恰好完全反应。
(2)求样品中硫酸钠的纯度_________。
(3)求恰好完全反应时所得溶液的溶质质量分数__________。(计算结果精确至0.1%)
【题目】现代生活中,人们越来越注重微量元素的摄取。碘元素对人体健康有至关重要的作用。下表是某地市场销售的一种“加碘食盐”包装袋上的部分说明:
配料 | 氯化钠、碘酸钾KIO3 |
含碘量 | 20mg-30mg/kg |
保质期 | 18个月 |
食用方法 | 勿长时间炖炒 |
贮存方法 | 避光、避热、密封、防潮 |
请回答下列问题:(除第(1)小题外,其它题均需写出解题过程)
(1)由食用方法和贮存方法可推测碘酸钾的化学性质之一是______;
(2)计算碘酸钾KIO3中,钾元素、碘元素、氧元素的质量比______;
(3)计算碘酸钾KIO3中,碘元素的质量分数______;精确到0.01%
(4)计算1kg这样的食盐中,应加入______g碘酸钾,用最高含碘量计算;精确到0.01%
(5)若含碘量按最高量计算,若要摄入0.15mg的碘元素,则应补充该加碘食盐______g。