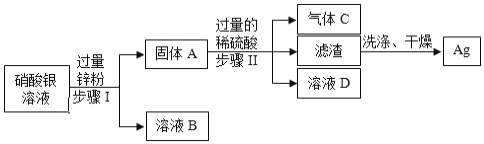
题目内容
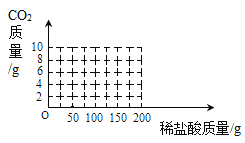
【题目】有一包含有碳酸钠和碳酸氢钠的混合物,为了测定其含量,取19.0g样品于烧杯中,加入100g水充分溶解,逐滴滴入稀盐酸并不断搅拌,反应过程中烧杯内溶液的总质量与加入稀盐酸的质量关系如下图曲线所示。

已知碳酸钠与盐酸反应时,先发生反应Ⅰ:Na2CO3+HCl=NaHCO3+NaCl,当Na2CO3全部转化为NaHCO3时,再发生反应Ⅱ:NaHCO3 + HCl=NaCl+H2O + CO2↑。回答下列问题:
(1)A点溶液的溶质是_______________。反应过程中生成二氧化碳的质量为_______g。
(2)计算所用稀盐酸溶质的质量分数_____________。(精确到0.1%)。
(3)请在如图中画出产生二氧化碳的曲线___________。
(4)样品中碳酸钠的质量是______g。
【答案】NaHCO3、NaCl 8.8 7.3%  10.6
10.6
【解析】
通过题意可知,该反应分为了两部分,即碳酸钠转化为碳酸氢钠后,在反应生成二氧化碳气体。根据质量守恒定律可知,在加入50g的盐酸时,溶液的质量为:19g+100g+50g=169g。则加入50g的盐酸中,没有生成二氧化碳气体。此后,加入盐酸的质量和图中溶液的质量不等,则此时产生二氧化碳气体。则AB段发生的是碳酸氢钠和稀盐酸反应生成氯化钠、水和二氧化碳的过程。待加入150g盐酸后,继续加入盐酸,此时溶液的质量再一次和加入的盐酸后的溶液的质量相等,则此时BC段不发生任何反应,盐酸过量。
(1)A点发生的反应是碳酸钠和盐酸反应生成氯化钠和碳酸氢钠,则A点的溶液的溶质为氯化钠和碳酸氢钠。根据质量守恒定律可知,反应生成的二氧化碳的质量为:150g+19g+100g-260.2g=8.8g。故答案为:NaHCO3和NaCl、8.8;
(2)设参加反应氯化氢的质量为x。

解得x=7.3g。则稀盐酸的质量分数为:![]()
(3)根据分析可知,滴加前50g稀盐酸时,溶液中不产生二氧化碳气体。当稀盐酸滴加量为50g~150g时,产生二氧化碳气体。当稀盐酸的滴加量超过150g时,不产生二氧化碳气体。故答案为: ;
;
(4)根据分析可知,前50g盐酸,将样品中的碳酸钠转化为碳酸氢钠。则50g盐酸中,氯化氢的质量为:50g×7.3%=3.65g。设原混合样品中,碳酸钠的质量为y。

解得y=10.6g。则原混合样品中,碳酸钠的质量为10.6g。