题目内容
【题目】(17分)实验室有一瓶长期暴露在空气中的氢氧化钠固体样品,观察发现,样品表面有白色粉末。某兴趣小组的同学对该样品的成分及含量进行了探究。
【提出问题1】该样品中含有哪些物质?
【提出猜想】通过分析,提出如下猜想:
猜想Ⅰ:已完全变质,该样品中只含Na2CO3;
猜想Ⅱ:部分变质,该样品中含有NaOH和Na2CO3。
(1)则NaOH变质反应的化学方程式为 。
【查阅资料】
①碱性的Na2CO3溶液可以与中性的CaCl2溶液发生复分解反应。
②二氧化碳在饱和的碳酸氢钠溶液中几乎不溶解,在27℃、101kPa时的密度为1.8 g·L-1。
【实验探究1】
(2)为确定该样品的成分,小明设计了如下实验方案,请你一起完成下列实验报告。
实验操作 | 实验现象 | 实验结论 |
(a)取少量样品溶于水,加入 ; | 有白色沉淀产生 | 该反应的化学方程式为 |
(b)静置,向 。 | 证明猜想Ⅱ成立 |
【提出问题2】如何测量该部分变质样品中碳酸钠的质量分数?
【实验探究2】
小红同学设计了如下图所示的装置(铁架台略去),在27℃、101kPa下按下列步骤进行实验:
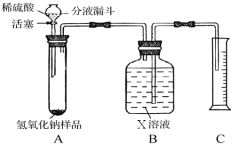
①按图连接好装置;
②用托盘天平准确称取该样品2g,放入A中试管内,向B中集气瓶中倒入X溶液至瓶颈处;
③向分液漏斗中加入稀硫酸,打开活塞,让稀硫酸滴入试管中至过量,关闭活塞。反应结束后,量筒中收集到X溶液220mL。
(3)在实验步骤①和②之间,还缺少一实验步骤,该实验步骤是 。
(4)B中集气瓶盛装的X溶液应为 溶液。
(5)试管中原有的空气对实验结果 (选填“有”或“没有”)明显影响。
(6)变质氢氧化钠样品中碳酸钠的质量分数为 (精确至1%)。
【提出问题3】怎样提纯该样品得到较纯净的氢氧化钠固体?
【实验探究3】
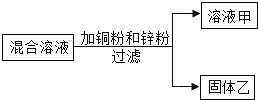
为了得到较纯净的氢氧化钠固体,小亮明设计了如下图所示的实验流程。
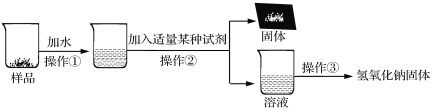
(7)操作②的名称是 ,为了使样品充分溶解,操作①中还要用到的玻璃仪器是 。
(8)该实验中发生反应的化学方程式为 。
(9)最终所得氢氧化钠固体的质量 变质样品中氢氧化钠的质量(选填“大于”、“等于”或“小于”)。
【反思与交流】
(10)敞口放置的氢氧化钠溶液容易变质,所以试剂瓶要 塞密封保存。
(11)通过本题,你学会了定性检验氢氧化钠的变质、定量测定变质后某成分的含量,以及除杂提纯物质。为了得到可靠的实验结果,探究过程中你需要思考问题有 (填数字序号);
①选择试剂种类
②确定试剂用量
③试剂产地
④实验装置与步骤的设计
⑤实验安全环保
⑥测量中减少误差
(12)【实验探究1】中的检验和【实验探究3】中的除杂都将碳酸钠进行了转化,但二者目的不同,它们分别是 。
【答案】(1)2NaOH + CO2 == Na2CO3 + H2O
(2)
实验操作 | 实验现象 | 实验结论 |
过量的CaCl2溶液 | CaCl2+Na2CO3==CaCO3↓+2NaCl | |
向上层清液中滴加酚酞溶液 | 变红 |
(3)检查装置的气密性
(4)饱和的碳酸氢钠
(5)没有
(6)48%
(7)过滤 玻璃棒
(8)Ca(OH)2+Na2CO3==CaCO3↓+2NaOH
(9)大于
(10)橡皮或橡胶
(11)①②④⑤⑥
(12)检验中将碳酸钠转化为氯化钠是为了消除对氢氧化钠检验的干扰,除杂中是将碳酸钠转化为产品氢氧化钠
【解析】
试题分析:(1)NaOH变质是吸收了空气中的二氧化碳,反应的化学方程式为:2NaOH + CO2 == Na2CO3 + H2O
(2)要确定该样品的成分,即既要证明是否含有碳酸钠还有证明是否含氢氧化钠,因为最终的实验结论是证明猜想Ⅱ成立,说明既有氢氧化钠,又有碳酸钠,所以在证明碳酸钠的同时,又不能影响氢氧化的检验,故不能加酸,这样会把氢氧化钠反应掉,无法检验氢氧化钠,也不能加碱,这样会生成新的碱,也同样影响氢氧化钠的检验,故只能加入盐溶液
实验操作 | 实验现象 | 实验结论 |
过量的CaCl2溶液 | CaCl2+Na2CO3==CaCO3↓+2NaCl | |
向上层清液中滴加酚酞溶液 | 变红 |
(3)由于实验过程中会产生气体,在实验步骤①和②之间,还缺少一实验步骤,该实验步骤是检查装置的气密性
(4)制得的二氧化碳气体中可能混有硫酸杂质,故B中集气瓶盛装的X溶液应为饱和的碳酸氢钠,以除去二氧化碳气体中的杂质,同时还可以防止二氧化碳溶解在水中
(5)由于主要是利用产生气体,形成压强,将装置B中的水压入量筒内,故试管中原有的空气对实验结果没有影响
(6)由于反应结束后,量筒中收集到X溶液220mL ,即反应产生的二氧化碳气体为220mL ,几根二氧化碳的密度,二氧化碳的质量=0.22L×1.8 g·L-1=0.396g,根据化学方程式:Na2CO3+H2SO4==Na2SO4+H2O+CO2↑中Na2CO3与CO2的质量关系,即可求出Na2CO3的质量,进而可计算变质氢氧化钠样品中碳酸钠的质量分数
解:设Na2CO3的质量为x
Na2CO3+H2SO4==Na2SO4/span>+H2O+CO2↑
106 44
x 0.396g
106:44=x:0.396g
x=0.954g
变质氢氧化钠样品中碳酸钠的质量分数=0.954g/2g×100%=48%
(7)操作②是将硅和液体分离,名称是:过滤;为了使样品充分溶解,操作①中还要用到的玻璃仪器是玻璃棒
(8)要除去氢氧化钠中的碳酸钠,加入的物质只能与碳酸钠反应,且不能引入新的杂质,所以应加入Ca(OH)2溶液,故发生反应的化学方程式为:Ca(OH)2+Na2CO3==CaCO3↓+2NaOH
(9)由于除碳酸钠杂质的时候生成了氢氧化钠,故最终所得氢氧化钠固体的质量大于变质样品中氢氧化钠的质量
(10)敞口放置的氢氧化钠溶液容易变质,故要密封保存,同时碱液会与玻璃中的二氧化硅反应,不能用玻璃瓶塞,所以试剂瓶要用橡皮或橡胶塞密封保存
(11)定性检验氢氧化钠的变质、定量测定变质后某成分的含量,以及除杂提纯物质,为了得到可靠的实验结果,探究过程中你需要思考问题除了不需要考虑试剂产地,其他①②④⑤⑥都需要考虑
(12)【实验探究1】中的检验和【实验探究3】中的除杂都将碳酸钠进行了转化,但二者目的不同,它们分别是:检验中将碳酸钠转化为氯化钠是为了消除对氢氧化钠检验的干扰,除杂中是将碳酸钠转化为产品氢氧化钠