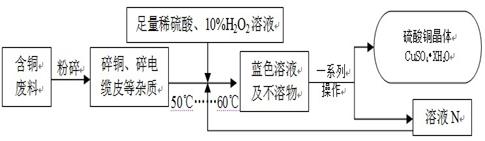
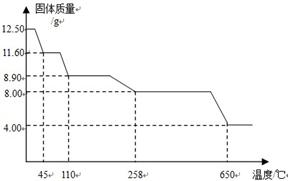
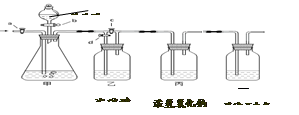
题目内容
近期我市三江县茶叶又在全国评比中获得金奖,可宇弘同学发现他家里承包种植的茶树叶子枯黄和脱落。于是他对此现象进行了资料查阅:他家的茶树适合在偏碱性的土壤中生长,不适合在偏酸性的土壤中生长。
(1)对此他提出以下猜想:①茶树叶子枯黄和脱落,可能是缺少氮肥引起的;②茶树叶子枯黄和脱落,也有可能是土壤呈 性引起的。
(2)请你为宇弘同学设计实验来验证土壤的酸碱性,以此证明猜想(2)成立(要求写出实验的步骤、现象和结论。)
(3)通过实验证明了宇弘同学的猜想②是造成茶树叶子枯黄和脱落的原因之一。要改良此土壤,以便适合茶树的生长,你建议宇弘同学应采取的措施是什么?并说出你的理由。
(1)对此他提出以下猜想:①茶树叶子枯黄和脱落,可能是缺少氮肥引起的;②茶树叶子枯黄和脱落,也有可能是土壤呈 性引起的。
(2)请你为宇弘同学设计实验来验证土壤的酸碱性,以此证明猜想(2)成立(要求写出实验的步骤、现象和结论。)
(3)通过实验证明了宇弘同学的猜想②是造成茶树叶子枯黄和脱落的原因之一。要改良此土壤,以便适合茶树的生长,你建议宇弘同学应采取的措施是什么?并说出你的理由。
(1)酸性
(2)
(3)采取的措施:向土壤中洒熟石灰。理由:熟石灰与酸性土壤发生中和反应。
(2)
| 实验的步骤 | 实验的现象 | 结论 |
| 取土壤样品于试管中,加适量水溶解。静止一段时间后取2ml的清液于试管中,再滴入几滴紫色石蕊试液。 | 紫色石蕊试液变成红色。 | 该土壤呈酸性 |
试题分析:(1)茶树叶子枯黄和脱落,也有可能是土壤呈酸性引起的;(2)
| 实验的步骤 | 实验的现象 | 结论 |
| 取土壤样品于试管中,加适量水溶解。静止一段时间后取2ml的清液于试管中,再滴入几滴紫色石蕊试液。 | 紫色石蕊试液变成红色。 | 该土壤呈酸性 |
点评:这是一道非常典型的探究题,题目给的知识点没有学过,较为陌生,但是重点考察的反应的思想,装置等,所以这种题目不要害怕,仔细审题即可。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目