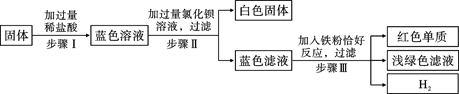
题目内容
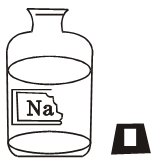
化学兴趣小组的同学在实验室发现一瓶保管不当,盛有无色 溶液的试剂瓶,且标签破损(如图),其残缺的标签中只剩下“Na”字 样。老师告诉他们,这瓶溶液中的溶质可能是氢氧化钠、氯化钠或碳酸钠。同学们很感兴趣,决定对其成分进行探究。
【提出问题】这瓶试剂可能是什么溶液呢?
【交流讨论】根据受损标签的情况判断,这瓶试剂不可能是 (填字母代号)。
A.酸 B.碱 C.盐
【查阅资料】碱性的Na2CO3溶液与中性的CaCl2溶液能发生复分解反应。
【作出猜想】(1)可能是 溶液;(2)可能是Na2CO3溶液;(3)可能是NaCl溶液。
【设计并实验】
由此,同学们得出结论:该溶液是碳酸钠溶液。
【反思】老师指出该结论不严密。理由是:氢氧化钠溶液在空气中敞开放置,发生变质,能产生与实验Ⅰ和Ⅱ相同现象。老师提示,不需另取样,只要在实验Ⅰ后的试管中加入足量CaCl2溶液,若观察到 现象,即可说明该溶液中有氢氧化钠。

【提出问题】这瓶试剂可能是什么溶液呢?
【交流讨论】根据受损标签的情况判断,这瓶试剂不可能是 (填字母代号)。
A.酸 B.碱 C.盐
【查阅资料】碱性的Na2CO3溶液与中性的CaCl2溶液能发生复分解反应。
【作出猜想】(1)可能是 溶液;(2)可能是Na2CO3溶液;(3)可能是NaCl溶液。
【设计并实验】
| 实验 | 实验操作 | 实验现象 | 实验结论和解释 |
| I | 取样于试管中,向其中滴加几滴 。 | 无色溶液变红 | 该溶液不可能是 溶液,理由是 。 |
| II | 另取样于试管中,向其中滴加足量的 。 | 产生大量气泡 | 该溶液为碳酸钠溶液,有关反应的化学方程式为 。 |
【反思】老师指出该结论不严密。理由是:氢氧化钠溶液在空气中敞开放置,发生变质,能产生与实验Ⅰ和Ⅱ相同现象。老师提示,不需另取样,只要在实验Ⅰ后的试管中加入足量CaCl2溶液,若观察到 现象,即可说明该溶液中有氢氧化钠。
【交流讨论】A 【作出猜想】(1)NaOH
【设计并实验】
【反思】:产生白色沉淀,溶液的红色不褪去
【设计并实验】
| 实验操作 | 实验结论和解释 |
| 酚酞试液 | NaCl,NaCl溶液不能使酚酞试液变红 |
| 稀盐酸 | Na2CO3+2HCl==2NaCl+H2O+CO2↑ |
试题分析:【交流讨论】由于破损标签的可见部分为“Na”,可判断该物质是由金属离子和未知的阴离子构成的,而酸类物质是由氢离子与酸根离子构成的,故可判断该物质不可能为酸。故选A
【作出猜想】根据所熟悉的常见的碱、盐的化学式,结合题意分析,应为氢氧化钠溶液。
【设计并实验】Ⅰ:根据实验现象“无色溶液变红”,结合猜想的物质可知,向溶液中滴加的应是无色酚酞试液;无色酚酞溶液变红,说明溶液呈碱性,而NaCl溶液呈中性,不能使酚酞变色,故不可能是氯化钠溶液。
Ⅱ:根据实验结论“该溶液为碳酸钠溶液”,以及实验现象“产生大量气泡”可知,向溶液中滴加的是稀酸溶液(如稀盐酸),因为酸能和碳酸钠反应生成二氧化碳气体,故有关反应的化学方程式为Na2CO3+2HCl=2NaCl+H2O+CO2↑。
【反思】若该溶液中有氢氧化钠和碳酸钠,则在实验Ⅰ后的试管中加入足量CaCl2溶液,能观察到有白色沉淀产生;且当碳酸钠完全反应后,由于有氢氧化钠的存在,溶液仍呈红色。
点评:对于验证型实验探究,要熟记物质的性质或变化规律,根据给出的实验设计方案,进行实验、分析和探究,并通过观察、记录和分析的实验现象,来验证该物质的性质或变化规律等。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 Na2CO3↑+CO2 ↑+H2O ;
Na2CO3↑+CO2 ↑+H2O ;