题目内容
(7分)现有下列装置,回答问题:
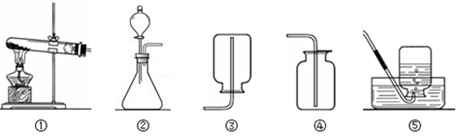
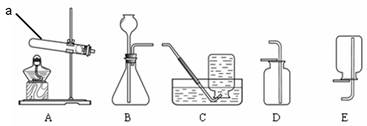
(1)能完成实验室制取二氧化碳气体的装置是 ▲ 和 ▲ (填数字);
(2)实验室制取二氧化碳气体的化学方程式是 ▲ ;
(3)能完成高锰酸钾制取氧气的装置是 ▲ 和 ▲ (填数字),实验室用高锰酸钾制取氧气的化学方程式为 ▲ ;
(4)将一定质量的高锰酸钾加热分解一段时间后,所得固体剩余物中Mn、O元素的质量比可能为 ▲ .

(1)能完成实验室制取二氧化碳气体的装置是 ▲ 和 ▲ (填数字);
(2)实验室制取二氧化碳气体的化学方程式是 ▲ ;
(3)能完成高锰酸钾制取氧气的装置是 ▲ 和 ▲ (填数字),实验室用高锰酸钾制取氧气的化学方程式为 ▲ ;
(4)将一定质量的高锰酸钾加热分解一段时间后,所得固体剩余物中Mn、O元素的质量比可能为 ▲ .
| A.55:64 | B.55:48 | C.1:1 | D.55:32 |
(1)② ④ (2)CaCO3 + 2HCl ="==" CaCl2 + H2O + CO2↑
(3)① ④或⑤ 2KMnO4△ K2MnO4 + MnO4 + O2↑ (4)BC
(3)① ④或⑤ 2KMnO4△ K2MnO4 + MnO4 + O2↑ (4)BC
(1)制取二氧化碳气体的反应是固体与液体的反应,及固液不加热反应,我们可以据此选择发生装置;根据收集气体的密度和溶解性选择收集装置应选② ④
(2)实验室常用大理石(或石灰石)和稀盐酸反应制取二氧化碳气体,因这两种药品反应速率适中,便于控制,利于气体收集;化学反应式是:CaCO3+2HCl═CaCl2+H2O+CO2↑;
(3)实验室用高锰酸钾制取氧气,是固体的加热反应,要收集干燥的气体可用排空气法收集,又因为氧气的密度大于空气的密度,我们可用向上排空气法收集所以要选用① ④或⑤加热高锰酸钾时生成了锰酸钾、二氧化锰、氧气,反应的方程式是:2KMnO4△ K2MnO4 + MnO4 + O2↑
(4)高锰酸钾中锰元素和氧元素的质量比是:55:64,如果高锰酸钾全部分解锰元素和氧元素的质量比是:55:64×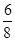 =55:48,因此所得固体剩余物中Mn、O元素的质量比在55:64和55:48之间,都可以.故答案为:BC
=55:48,因此所得固体剩余物中Mn、O元素的质量比在55:64和55:48之间,都可以.故答案为:BC
(2)实验室常用大理石(或石灰石)和稀盐酸反应制取二氧化碳气体,因这两种药品反应速率适中,便于控制,利于气体收集;化学反应式是:CaCO3+2HCl═CaCl2+H2O+CO2↑;
(3)实验室用高锰酸钾制取氧气,是固体的加热反应,要收集干燥的气体可用排空气法收集,又因为氧气的密度大于空气的密度,我们可用向上排空气法收集所以要选用① ④或⑤加热高锰酸钾时生成了锰酸钾、二氧化锰、氧气,反应的方程式是:2KMnO4△ K2MnO4 + MnO4 + O2↑
(4)高锰酸钾中锰元素和氧元素的质量比是:55:64,如果高锰酸钾全部分解锰元素和氧元素的质量比是:55:64×
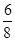 =55:48,因此所得固体剩余物中Mn、O元素的质量比在55:64和55:48之间,都可以.故答案为:BC
=55:48,因此所得固体剩余物中Mn、O元素的质量比在55:64和55:48之间,都可以.故答案为:BC
练习册系列答案
 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目