题目内容
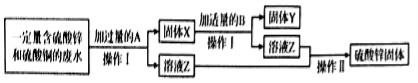
【题目】课外小组的同学设计用氢氧化钠溶液来“捕捉”二氧化碳,其基本过程如下(部分条件及物质未标出)。请回答下列有关问题:
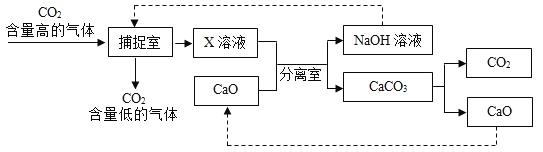
(1)“捕捉室”中发生反应的化学方程式为_____;
(2)分离室采用的操作方法名称是_____;
(3)整个过程中没有涉及的基本化学反应类型是_____;
(4)在整个“捕捉”过程中,可以循环利用的物质是_____(填名称);
(5)通过计算,20吨溶质质量分数为20%的氢氧化钠溶液,能捕捉_____吨的 CO2。
【答案】CO2+2NaOH=Na2CO3+H2O 过滤 置换反应 氧化钙和氢氧化钠 2.2
【解析】
二氧化碳和氢氧化钠溶液反应生成碳酸钠和水;
不溶性固体与液体分开用过滤;
根据反应的化学方程式结合题干提供的数据进行计算。
(1)“捕捉室”中二氧化碳和氢氧化钠溶液反应生成碳酸钠和水,反应的化学方程式为CO2+2NaOH=Na2CO3+H2O;故填:CO2+2NaOH=Na2CO3+H2O;
(2)分离室将氢氧化钠溶液和碳酸钙固体分开,固体与液体分开用过滤;故填:过滤;
(3)利用氧化钙和水反应制取氢氧化钙,属于化合反应;分离室中碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,该反应属于复分解反应;“捕捉室”中二氧化碳和氢氧化钠溶液反应生成碳酸钠和水,不属于基本反应类型;碳酸钙高温生成氧化钙和二氧化碳属于分解反应;该过程中有涉及的基本化学反应类型是置换反应。故填:置换反应;
(4)碳酸钠与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,氢氧化钠又是捕捉室中的反应物,所以可以循环利用;碳酸钙高温生成氧化钙和二氧化碳,观察图示,氧化钙还可循环利用,氧化钙和氢氧化钠都可以循环利用。故填:氧化钙和氢氧化钠;
(5)设20吨溶质质量分数为20%的氢氧化钠溶液,能捕捉二氧化碳的质量为x
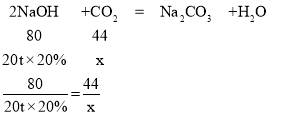
x=2.2t
答:能捕捉二氧化碳的质量为2.2t。
故填:2.2。

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
走进文言文系列答案