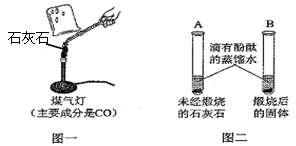
题目内容
实验室有一瓶久置的氧化钙,因吸收空气中的水蒸气和二氧化碳而变质,经测定该固体中 氢元素的质量分数为0.8%,碳元素的质量分数为2.4%。则已变质的氧化钙占变质前纯氧化钙的质量分数为( )
| A.80% | B.66.7% | C.40% | D.18.8% |
C
解析试题分析:氧化钙与水反应生成的氢氧化钙中含有氢元素,氢元素的质量分数为0.8%;生成的碳酸钙中含有碳元素,碳元素的质量分数为2.4%。设变质后的固体的质量为100,则氢元素质量为0.8,碳元素质量为2.4,设含有氢氧化钙、碳酸钙质量分别为a、b,反应的氧化钙质量分别为x、y,利用变化前后每种元素的原子个数不变可得关系式为:CaO︿Ca(OH)2︿2H
56 74 2
X a 0.8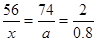 x=22.4 a="29.6"
x=22.4 a="29.6"
CaO︿CaCO3︿C
56 100 12
y b 2.4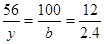 y=11.2 b=20
y=11.2 b=20
则变质后的固体中没变质的氧化钙的质量为:100-29.6-20=50.4,变质的氧化钙的质量为:22.4+11.2=33.6,变质前的氧化钙的总质量为50.4+33.6=84,已变质的氧化钙占变质前纯氧化钙的质量分数为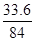 ×100%=40%,故选C
×100%=40%,故选C
考点:氧化钙的性质;化学方程式的计算;质量守恒定律

 名校课堂系列答案
名校课堂系列答案(6分)将4.0gCu – Zn合金粉末放到盛有10g稀硫酸的烧杯中,恰好完全反应。过滤、称量滤液的质量。相关实验数据如下:
| 反应前物质的质量 / g | 反应后物质的质量 / g | |
| Cu – Zn合金 | 稀硫酸 | 滤液 |
| 4.0 | 10 | 11.26 |
(2)若不考虑该合金中除Cu、Zn以外的其他成分,请计算原Cu – Zn合金中Zn的质量。写出必要的计算过程。
有铜铝合金8.1g放入300g溶质质量分数为9.8%的稀硫酸中,可能产生氢气的质量是
| A.0.32g | B.0.65g | C.0.84g | D.0.90g |
将6.96 g铁的某种氧化物在高温下与足量的一氧化碳充分反应,生成5.28 g二氧化碳,则这种铁的氧化物应该为
| A.FeO | B.Fe2O3 | C.Fe3O4 | D.无法确定 |
有一包“铁”的粉末,可能含有Fe 、Fe2O3 Fe3O4中的一种或几种,现称取23.2g放在试管中,通入足量的一氧化碳并加热充分反应,将生成的气体全部通入足量的澄清石灰水,共得到40g的碳酸钙固体。关于这包“铁” 的粉末成分判断正确的是
| A.一定是纯净物 | B.一定有Fe 、Fe2O3Fe3O4三种 |
| C.如果有Fe ,就一定有Fe2O3 | D.如果有Fe2O3,就一定有Fe3O4 |
某合金6 g与足量的稀硫酸充分反应后,如果生成0.2 g氢气,该合金中的元素可能是( )
| A.Zn和Fe | B.Cu和Au |
| C.Zn和Cu | D.Mg和Al |