题目内容
(8分)同学们对实验“煅烧石灰石”展开深入探究。
资料:石灰石中的杂质高温不分解且不与稀盐酸反应
(1)为证明石灰石已分解,三位同学设计方案如下:
Ⅰ.甲同学按图一所示进行实验(煤气灯亦能达到石灰石分解的温度),观察到烧杯内壁石灰水变浑浊,写出石灰水发生反应的化学方程式 。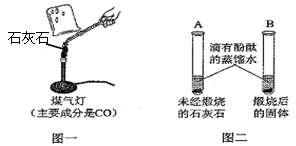
II.乙同学按图二所示进行试验,观察到B中液体变 色,A实验的作用 。
III.丙同学取一块质量为12g的石灰石煅烧,一段时间后发现固体质量减轻2.2g,证明石灰石已分解。
IV.大家认为甲同学的方案不合理,请分析原因 。
(2)为测定石灰石的纯度,丙同学将他刚才煅烧后的固体放入足量稀盐酸中,又产生2.2g气体,结合上述数据计算:丙所取的这块石灰石中碳酸钙的质量分数是多少?
计算过程写在答卷上
(1)ⅠCO2+Ca(OH)2=CaCO3↓+H2O Ⅱ 红 对比 Ⅳ CO燃烧会产生CO2
(2)83.3%
解析试题分析:(1)Ⅰ、烧杯内壁石灰水变浑浊,发生的化学反应方程式为:CO2+Ca(OH)2=CaCO3↓+H2O,
Ⅱ、乙同学按图二所示进行试验,未煅烧的石灰石不溶于水,煅烧后生成了氧化钙,氧化钙和水发生反应,生成了氢氧化钙,水溶液呈碱性,所以滴入酚酞的蒸馏水后,液体变为红色,A实验的作用对比
IV、甲同学的方案不合理的原因是:煤气灯的燃料是一氧化碳,而CO燃烧会产生CO2
(2)根据反应:CaCO3 CaO+CO2↑,丙同学取一块质量为12g的石灰石煅烧,一段时间后发现固体质量减轻2.2g,说明该反应生成了2.2g二氧化碳,这样便可计算出发生分解的碳酸钙质量,丙同学将他刚才煅烧后的固体放入足量稀盐酸中,又产生2.2g气体,说明发生了反应:CaCO3+2HCl==CaCl2+H2O+CO2↑,这样同样可以计算出剩余碳酸钙的质量
CaO+CO2↑,丙同学取一块质量为12g的石灰石煅烧,一段时间后发现固体质量减轻2.2g,说明该反应生成了2.2g二氧化碳,这样便可计算出发生分解的碳酸钙质量,丙同学将他刚才煅烧后的固体放入足量稀盐酸中,又产生2.2g气体,说明发生了反应:CaCO3+2HCl==CaCl2+H2O+CO2↑,这样同样可以计算出剩余碳酸钙的质量
解:设加热分解的碳酸钙的质量为x
CaCO3 CaO+CO2↑
CaO+CO2↑
100 44
x 2.2g
100:44=x:2.2g x=5g
设剩余碳酸钙的质量为y
CaCO3+2HCl==CaCl2+H2O+CO2↑
100 44
y 2.2g
100:44=y:2.2g y=5g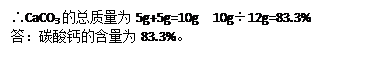
考点:碳酸钙、氧化钙、氢氧化钙的化学性质,根据化学方程式计算

 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案实验室有一瓶久置的氧化钙,因吸收空气中的水蒸气和二氧化碳而变质,经测定该固体中 氢元素的质量分数为0.8%,碳元素的质量分数为2.4%。则已变质的氧化钙占变质前纯氧化钙的质量分数为( )
| A.80% | B.66.7% | C.40% | D.18.8% |
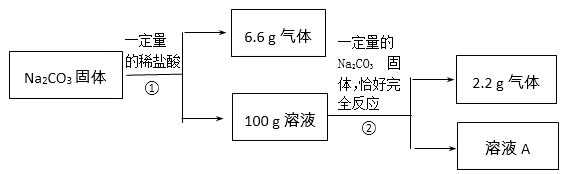
某同学在实验室发现一瓶由碳酸钠和氯化钠组成的混合溶液.为了测定该混合溶液中碳酸钠的质量分数,该同学设计了如下实验:取该混合溶液50g,向其中逐滴加入稀盐酸,当加入盐酸的质量为15g、30g、45g、60g时,生成气体的质量见下表(气体的溶解度忽略不计).
| | 第Ⅰ组 | 第Ⅱ组 | 第Ⅲ组 | 第Ⅳ组 |
| 稀盐酸的质量/g | 15 | 30 | 45 | 60 |
| 生成气体的质量/g | 1.8 | n | 4.4 | 4.4 |
(2)混合溶液中碳酸钠的质量分数是多少?(写出计算过程,结果精确至0.1%)
某化学兴趣小组为了测定镁铜合金中镁的质量分数,取出3g合金样品,将60g稀硫酸分6次加入样品中,充分反应后过滤、洗涤、干燥、称重,得到的实验数据如下:
| 稀硫酸用量 | 剩余固体质量 | 稀硫酸用量 | 剩余固体质量 |
| 第一次加入10g | mg | 第四次加入10g | 1.0g |
| 第二次加入10g | 2.0g | 第五次加入10g | 0.6g |
| 第三次加入10g | 1.5g | 第六次加入10g | 0.6g |
(2)第六次实验后,所得溶液中硫酸镁的质量分数(要求写出计算过程,结果保留到0.1%)