题目内容
二氧化碳是一种奇妙的气体,在实验室可以很方便的制取.
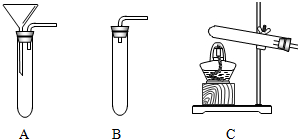
(1)实验室制取二氧化碳,发生装置可选用如图中的 (填字母),化学方程式为 ;
(2)组装好仪器后,将导管末端浸末在水中,用手捂试管,发现导管口有气泡,放手后,会 ,说明气密性良好;
(3)用向上排空法收集二氧化碳时,验满的方法 ;
(4)小李同学用浓盐酸与石灰石制得的二氧化碳通入澄清石灰水中, (填“一定”或“不一定”)能看见浑浊;
(5)要除去收集到的二氧化碳中混有的氯化氢气体,可以选择 (填字母)
A.氢氧化钠 B.饱和碳酸氢钠溶液 C.浓硫酸
(6)测出小李同学实验后所得废液pH<7,则该废液中存在的阳离子为 ;
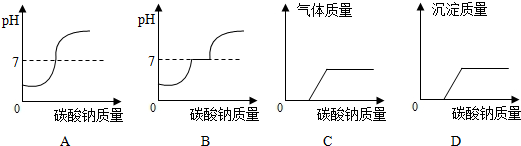
(7)向该废液滴加碳酸钠溶液至过量,则如图表示正确的为 .

(1)实验室制取二氧化碳,发生装置可选用如图中的
(2)组装好仪器后,将导管末端浸末在水中,用手捂试管,发现导管口有气泡,放手后,会
(3)用向上排空法收集二氧化碳时,验满的方法
(4)小李同学用浓盐酸与石灰石制得的二氧化碳通入澄清石灰水中,
(5)要除去收集到的二氧化碳中混有的氯化氢气体,可以选择
A.氢氧化钠 B.饱和碳酸氢钠溶液 C.浓硫酸
(6)测出小李同学实验后所得废液pH<7,则该废液中存在的阳离子为
(7)向该废液滴加碳酸钠溶液至过量,则如图表示正确的为

考点:二氧化碳的实验室制法,检查装置的气密性,常见气体的检验与除杂方法,二氧化碳的检验和验满,溶液的酸碱性与pH值的关系,盐的化学性质,书写化学方程式、文字表达式、电离方程式
专题:常见气体的实验室制法、检验、干燥与净化
分析:(1)实验室中通常是用大理石或石灰石和稀盐酸反应制取二氧化碳;
(2)制取气体或有气体参加的反应都要检验装置的气密性;
(3)二氧化碳不能燃烧、不支持燃烧,能使澄清的石灰水变浑浊;
(4)碳酸钙能和稀盐酸反应生成氯化钙、水和二氧化碳;
(5)二氧化碳不能和碳酸氢钠反应,氯化氢能和碳酸氢钠反应生成氯化钠、水和二氧化碳;
(6)稀盐酸和碳酸钙反应后,溶液显酸性,说明稀盐酸过量;
(7)废液中含有氯化钙和稀盐酸,加入碳酸钠溶液时,先和稀盐酸反应生成氯化钠、水和二氧化碳,当稀盐酸完全反应后,再和氯化钙反应生成碳酸钙沉淀和氯化钠.
(2)制取气体或有气体参加的反应都要检验装置的气密性;
(3)二氧化碳不能燃烧、不支持燃烧,能使澄清的石灰水变浑浊;
(4)碳酸钙能和稀盐酸反应生成氯化钙、水和二氧化碳;
(5)二氧化碳不能和碳酸氢钠反应,氯化氢能和碳酸氢钠反应生成氯化钠、水和二氧化碳;
(6)稀盐酸和碳酸钙反应后,溶液显酸性,说明稀盐酸过量;
(7)废液中含有氯化钙和稀盐酸,加入碳酸钠溶液时,先和稀盐酸反应生成氯化钠、水和二氧化碳,当稀盐酸完全反应后,再和氯化钙反应生成碳酸钙沉淀和氯化钠.
解答:解:
(1)实验室经常选用稀盐酸和大理石或石灰石反应来制取二氧化碳,发生装置应该用B装置,因为反应不需要加热,A装置中生成的二氧化碳会从漏斗中逸出,大理石或石灰石的主要成分是碳酸钙,碳酸钙和稀盐酸反应能生成氯化钙、水和二氧化碳,反应的化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑.
故填:B;CaCO3+2HCl=CaCl2+H2O+CO2↑.
(2)组装好仪器后,将导管末端浸末在水中,用手捂试管,发现导管口有气泡,放手后,会发现导管中有一小段水柱,说明气密性良好.
故填:发现导管中有一小段水柱.
(3)用排空法收集二氧化碳,验满时可用燃烧的木条,将燃着的木条置于集气瓶口,若木条熄灭,证明气体收集已满.
(4)用某浓盐酸与石灰石制得的二氧化碳通入澄清石灰水中,则澄清石灰水不一定变浑浊,因为浓盐酸易挥发,挥发出的氯化氢气体随二氧化碳进入石灰水中,能和石灰水中的氢氧化钙反应生成氯化钙和水.
故填:不一定.
(5)要除去收集到的二氧化碳中混有的少量氯化氢气体,最好用碳酸氢钠溶液,因为二氧化碳不能和碳酸氢钠反应,氯化氢能和碳酸氢钠反应生成氯化钠、水和二氧化碳,而氢氧化钠和氢氧化钙既能够和二氧化碳反应,也能够和氯化氢反应;用浓硫酸不能除去氯化氢气体.
故填:B.
(6)测出该废液pH<7,说明稀盐酸过量,则废液中大量存在的阳离子为钙离子和氢离子,符号分别是Ca2+、H+.
故填:Ca2+、H+.
(7)向此废液滴加碳酸钠溶液至过量,碳酸钠先和稀盐酸反应生成氯化钠、水和二氧化碳,当稀盐酸完全反应后,再和氯化钙反应生成碳酸钙沉淀和氯化钠,B和D符合题意.
故填:BD.
故答案为:
(1)B;CaCO3+2HCl=CaCl2+H2O+CO2↑.
(2)发现导管中有一小段水柱.
(3)将燃着的木条置于集气瓶口,若木条熄灭,证明气体收集已满.
(4)不一定.
(5)B.
(6)Ca2+、H+.
(7)BD.
(1)实验室经常选用稀盐酸和大理石或石灰石反应来制取二氧化碳,发生装置应该用B装置,因为反应不需要加热,A装置中生成的二氧化碳会从漏斗中逸出,大理石或石灰石的主要成分是碳酸钙,碳酸钙和稀盐酸反应能生成氯化钙、水和二氧化碳,反应的化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑.
故填:B;CaCO3+2HCl=CaCl2+H2O+CO2↑.
(2)组装好仪器后,将导管末端浸末在水中,用手捂试管,发现导管口有气泡,放手后,会发现导管中有一小段水柱,说明气密性良好.
故填:发现导管中有一小段水柱.
(3)用排空法收集二氧化碳,验满时可用燃烧的木条,将燃着的木条置于集气瓶口,若木条熄灭,证明气体收集已满.
(4)用某浓盐酸与石灰石制得的二氧化碳通入澄清石灰水中,则澄清石灰水不一定变浑浊,因为浓盐酸易挥发,挥发出的氯化氢气体随二氧化碳进入石灰水中,能和石灰水中的氢氧化钙反应生成氯化钙和水.
故填:不一定.
(5)要除去收集到的二氧化碳中混有的少量氯化氢气体,最好用碳酸氢钠溶液,因为二氧化碳不能和碳酸氢钠反应,氯化氢能和碳酸氢钠反应生成氯化钠、水和二氧化碳,而氢氧化钠和氢氧化钙既能够和二氧化碳反应,也能够和氯化氢反应;用浓硫酸不能除去氯化氢气体.
故填:B.
(6)测出该废液pH<7,说明稀盐酸过量,则废液中大量存在的阳离子为钙离子和氢离子,符号分别是Ca2+、H+.
故填:Ca2+、H+.
(7)向此废液滴加碳酸钠溶液至过量,碳酸钠先和稀盐酸反应生成氯化钠、水和二氧化碳,当稀盐酸完全反应后,再和氯化钙反应生成碳酸钙沉淀和氯化钠,B和D符合题意.
故填:BD.
故答案为:
(1)B;CaCO3+2HCl=CaCl2+H2O+CO2↑.
(2)发现导管中有一小段水柱.
(3)将燃着的木条置于集气瓶口,若木条熄灭,证明气体收集已满.
(4)不一定.
(5)B.
(6)Ca2+、H+.
(7)BD.
点评:化学实验现象是化学实验最突出、最鲜明的部分,也是进行分析推理得出结论的依据,掌握物质的性质和相互之间的反应关系,有助于提高观察实验、进行实验的能力.所以,对化学实验不仅要认真观察,还应掌握设计实验、观察实验现象的方法.

练习册系列答案
相关题目
铁丝在氧气中燃烧,能说明该变化是化学变化的依据是( )
| A、火星四射 | B、放出热量 |
| C、生成黑色固体 | D、铁丝变短 |
 实验室常用大理石和稀盐酸制取二氧化碳,请回答下列问题:
实验室常用大理石和稀盐酸制取二氧化碳,请回答下列问题: