题目内容
【题目】为减少温室气体排放,人们积极寻找不含碳元素的燃料。经研究发现氨气( NH3 )燃烧的产物没有污染,有很高的应用前景。其微观过程如下图所示:
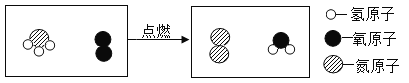
该反应前后化合价发生变化的元素有_____;该反应的化学方程式为_____;生成物的质量比为_____。
【答案】氮元素和氧元素 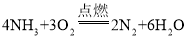 14:27
14:27
【解析】
由微观过程图可知,氨分子和氧分子反应生成氮气分子和水分子,则有:
反应前,氨气中氮元素为-3价,氢元素为+1价,氧气中氧元素为0价,反应后氮气中氮元素为0价,水中氢元素为+1价,氧元素为-2价,该反应前后化合价发生变化的元素有氮元素和氧元素;
氨气和氧气反应生成氮气和水,该反应的化学方程式为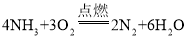 ;
;
根据上述方程式可知生成物的质量比为![]() 。
。

 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案【题目】某兴趣小组对KClO3分解反应的催化剂进行研究,在相同的加热条件下,用下图装置完成表中实验:
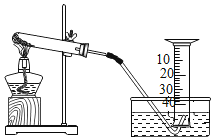
编号 | KClO3质量/g | 催化剂 | 催化剂质量/g | 收集50mLO2所需时间/s |
实验1 | 5 | - | - | 171 |
实验2 | 5 | MnO2 | 0.5 | 49 |
实验3 | 5 | Fe2O3 | 0.5 | 58 |
实验4 | 5 | KCl | 0.5 | 154 |
(1)设置实验1的目的是___________________
(2)表中所列3种催化剂的催化效果最佳的是______________
(3)写出KClO3分解的化学方程式:_________________________
(4)由实验1和实验4可知,KCl____(填“有”或“无”)催化作用。维持加热条件不变,用实验1再继续收集收集50mLO2,所需时间明显少于171s,解释原因:_____________
(5)要比较KClO3分解反应中不同催化剂的催化效果,除了测量收集50mLO2所需时间外,还可以测量相同时间内____________
【题目】下表是KNO3,在不同温度时的溶解度,回答问题。
温度/C | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
溶解度/g | 45.8 | 63.9 | 85.5 | 110 | 138 | 169 | 202 |
(1)30℃时KNO3溶液的溶质质量分数的最大值是_____(只列出表达式)
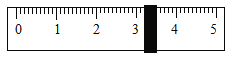
(2)90℃时,将一定质量的KNO3溶液按图示进行操作:
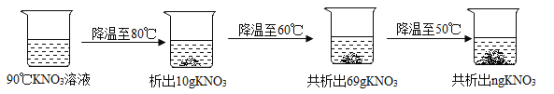
90℃时的KNO3溶液是____(填“饱和“或“不饱和")溶液。图中n的数值为___。
【题目】小明在做实验时, 不小心将镁条掉入到碳酸氢钠溶液中,发现产生大量的气泡和白色不溶物。他
非常好奇,进行了如下探究。
实验探究1 :镁条与碳酸氢钠溶液反应产生什么气体?
甲同学猜想:可能是二氧化碳;
乙同学猜想:可能是氢气。
同学们作出猜想的依据是_____。
[设计实验]将产生的气体收集起来,做如下实验:
实验步骤 | 实验现象 | 实验结论 |
将收集的气体通入澄清石灰水中 | _____ | 甲同学猜想错误 |
将收集的气体点燃 | 气体燃烧,产生淡蓝色火焰,有尖锐的爆鸣声 | 乙同学猜想正确 |
实验探究2:产生的白色不溶物是什么?
[查阅资料]Mg(OH)2难溶于水;MgCO3微溶于水;这两种物质受热都会分解成两种氧化物。
[提出猜想]猜想 1:白色固体是Mg(OH)2;
猜想2:白色固体是MgCO3;
猜想3:_____。
[定性研究]取白色固体于试管中,滴加足量的稀盐酸,观察到_____,得出猜想1一定不正确。
写出产生该现象的反应化学方程式_____。
小明通过进一步实 验验证得出猜想3成立,写出实验操作及实验现象_____。
[定量研究]若现有10.0 g该白色固体,请设计实验方案并同时说明要测定的量(用a表示) ,并计算白色固体中MgCO3的质量分数(不要求写出计算过程)_____。