题目内容
【题目】金属是重要的资源,与我们的生活息息相关。
(1)铜制插头是利用了金属铜的____性。选择锰钢而不用纯铁制造自行车车架的主要原因是_______。
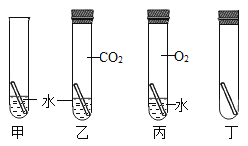
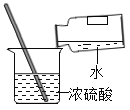
(2)小明同学探究铝、铜、银三种金属的活动性顺序,设计了如图所示的方案。
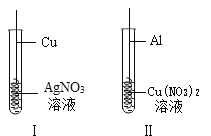
①I中发生反应的化学方程式为____________。一段时间后可观察到II中铝丝表面_________________。
②通过以上实验,______ (填“能”或“不能”)得出三种金属的金属活动性由强到弱的顺序为:Al>Cu>Ag
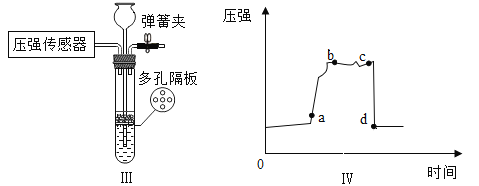
(3)实验室用锌粒和稀硫酸制取氢气的化学方程式为____________。Ⅲ可作为制取氢气的发生装置,为研宄该装置的工作原理,利用压强传感器测定制取氢气过程中的压强变化(如IV所示)。请描述ab时间段装置内出现的现象__________________。cd时间段对应的操作是_______
(4)己知碳在高温时与氧化锌完全反应得到锌和二氧化碳,要使81g氧化锌完全还原,需要碳的质量至少是多少?(写出计算过程)__________
【答案】导电 锰钢硬度大于纯铁 ![]() 逐渐生成一层红色固体 能
逐渐生成一层红色固体 能 ![]() 锌粒表面持续产生气泡,试管内液面逐渐下降至多孔隔板以 下 打开弹簧夹 6g
锌粒表面持续产生气泡,试管内液面逐渐下降至多孔隔板以 下 打开弹簧夹 6g
【解析】
(1)铜制插头是利用铜导电,故是利用了铜的导电性;
锰钢属于铁的合金,合金比组成它的纯金属的硬度大,抗腐蚀性好,选择锰钢而不用纯铁制造自行车车架的主要原因是:锰钢硬度大于纯铁;
(2)①I中发生反应为铜与硝酸银反应生成硝酸铜和银,该反应的化学方程式为:![]() ;
;
II中铝与硝酸铜反应生成硝酸铝和铜,故一段时间后,可观察到II中铝丝表面逐渐生成一层红色固体;
②铝能与硝酸铜反应生成硝酸铝和铜,说明在金属活动性顺序里,铝的金属活动性比铜强,铜能与硝酸银反应生成硝酸铜和银,说明在金属活动性顺序里,铜比银活泼,故通过以上实验,能得出三种金属的金属活动性由强到弱的顺序为:Al>Cu>Ag;
(3)实验室用锌粒和稀硫酸反应制取氢气,锌与稀硫酸反应生成硫酸锌和氢气,该反应的化学方程式为:![]() ;
;
ab段压强逐渐增大,说明锌与稀硫酸反应生成了氢气,气体增多,装置内压强增大,在压强差的作用下,试管里的液体被压入长颈漏斗中,故实验现象为:锌粒表面持续产生气泡,试管内液面逐渐下降至多孔隔板以下,反应停止没有气泡生成;
cd时间段压强逐渐减小至恢复原大小,故应该是打开了弹簧夹,试管内的气体逸出,压强减小,故填:打开弹簧夹;
(4)解:设需要碳的质量为x
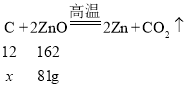
![]()
x=6g
答:需要碳的质量为6g。

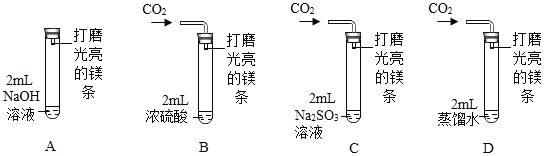
【题目】某班学生在老师指导下探究铁与水蒸气的反应,请帮助他完成下列实验报告。
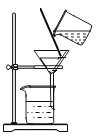
(1)按图甲装好药品,连接装置(夹持仪器已略去)。其中A装置的作用是:_______
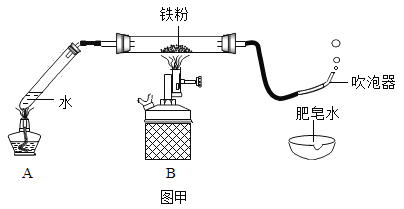
(2)加热一段时间后,灰色铁粉逐渐变黑,吹泡器连续吹出气泡,且气泡向上飞起;用燃着的木条靠近气泡,能产生爆鸣。
(3)同学们讨论后认为:铁与水蒸气反应生成的固体是“铁的一种氧化物”,玻璃管内的黑色固体中还可能含有“过量的铁”。
(查阅资料)铁有三种氧化物(FeO、Fe2O3、Fe3O4),其中FeO接触到空气会立即由黑色变为红棕色;铁的三种氧化物都不与硫酸铜溶液反应。
(实验探究)
实验步骤 | 实验现象 | 实验结论 |
倒出玻璃管中黑色固体,平铺于白纸上 | 黑色固体不变色 | 黑色固体中一定没 有_____(填物质名称) |
取上述黑色固体少许,装入试管,加入足量硫酸铜溶液 | _____ ,有红色固体出现 | 黑色固体中一定 含有_____。 |
【题目】已知 KNO3的溶解度如下表所示,下列说法不正确的是
温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
溶解度/g | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 |
A.在 10℃-70℃之间,随着温度的升高,KNO3的溶解度增大
B.20℃时,向 100 g 水中加入 35 g KNO3,充分搅拌,所得溶液质量为 131.6 g
C.将 70℃时不饱和的 KNO3溶液降低温度,有可能转化为饱和溶液
D.50℃时,饱和 KNO3溶液中溶质的质量分数为 85.5%