题目内容
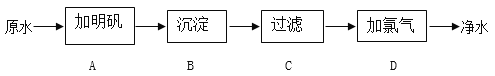
【题目】目前,我国钢铁产量居世界第一,为国民经济的发展奠定了坚实的基础。
(一)铁的广泛应用
(1)认识铁:从宏观看,铁由______组成;从微观看,铁由_________构成。我国在西汉时期就有“曾青得铁则化为铜”之说,其化学方程式是______________________。
(2)生活中:右图是常用的铁锅。用铁锅做炊具,是利用了铁的___________性。防止铁锅生锈,通常采用的方法是____________。

(3)实验室:铁丝在纯净氧气中燃烧的化学反应方程式为__________。铁丝燃烧时火星四射,经研究表明产生火星四射现象的原因,可能是同时生成了某种气体,推测该气体是___________(填化学式)。
(二)铁锈蚀的条件探究
(4)铁在潮湿的空气里容易发生锈蚀,证明水一定参加了反应,必须要做的对比实验是_______(填字母)。
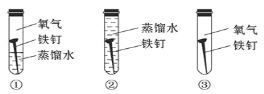
A.①② B.①③ C.②③ D.①②③
(5)一般情况下,两种活动性不同的金属在潮湿的环境中接触时,活动性强的金属首先被腐蚀。造船工业为了避免轮船的钢铁外壳被腐蚀,通常在轮船外壳镶嵌的是_____(填“锌块”或“铜块”)。
(6)如图所示,将包有样品的滤纸包用大头针固定在橡胶塞上,迅速塞紧,观察到量筒内水沿着细导管慢慢进广口瓶(容积为150mL)。当温度恢复至室温,且量筒内水面高度不变时读数(此时瓶内氧气含量近似为零)。记录起始和最终量筒的读数以及所需时间如下表。(滤纸包等所占体积忽略不计)
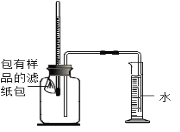
序号 | 样品 | 量筒起始读数 | 量筒最终读数 | 所需时间/min |
1 | 1g铁粉、0.2 g碳和10滴水 | 100 mL | 72 mL | 约120 |
2 | 1g铁粉、0.2g碳、10滴水和少量NaCl | 100 mL | 72 mL | 约70 |
3 | / | / | / |
①铁锈的主要成分是______(写化学式)。
②实验1和2说明NaCl可以_______(填“加快”或“减慢”)铁锈蚀的速率。
③实验开始后广口瓶内温度上升,说明铁锈蚀过程是______(填“放热”或“吸热”)过程。④实验1和3是探究碳对铁锈蚀速率的影响,表格空白处应填写的实验3的样品组成是________。
⑤该装置还可用于测量空气中氧气的体积分数。根据上述数据计算氧气的体积含量是________%(精确到小数点后1位)。
(三)铁的冶炼
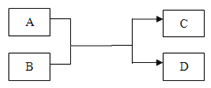
(7)某钢铁厂炼铁的主要原料是焦炭、赤铁矿(主要成分为氧化铁)、石灰石等,炼铁设备--高炉结构如图所示,请回答下列问题:
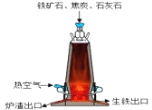
①炼铁的固体原料需预先经过粉碎,其目的是___________。
②炼铁高炉内发生的主要过程如下:
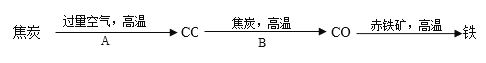
写出步骤写出A、B两步反应的化学方程式:
A:_____________,B:________________
③资料显示,炼铁中焦炭的实际用量远高于理论值,可能原因是______(填字母)。
A.部分焦炭与铁相互熔合,成为生铁中的部分碳元素
B.焦炭转变成一氧化碳后,并不能全部参加反应
C.焦炭在高温下会分解
④某炼铁厂现用100t含氧化铁80%的赤铁矿石炼铁,计算理论上可以炼出含铁96%的生铁的质量__________span>。(计算结果精确到0.1t)
【答案】铁元素 铁原子 Fe+CuSO4==FeSO4+Cu 导热 及时擦干 3Fe+2O2![]() Fe3O4 CO2 B 锌块 Fe2O3 加快 放热 1g铁、10滴水 18.7% 增大接触面积,加快反应速率(使反应充分) C+O2
Fe3O4 CO2 B 锌块 Fe2O3 加快 放热 1g铁、10滴水 18.7% 增大接触面积,加快反应速率(使反应充分) C+O2![]() CO2 CO2+C
CO2 CO2+C![]() 2CO AB 58.3t(过程略)
2CO AB 58.3t(过程略)
【解析】
(1)从宏观上看,物质是由元素组成的,从微观上看,物质是由粒子构成的,铁是由铁元素组成的,是由铁原子构成的;曾青就是硫酸铜溶液,因为它是蓝绿色的,该反应就是铁和硫酸铜反应生成铜硫酸亚铁,铜附着在铁的表面,反应方程式为:Fe +CuSO4====Cu +FeSO4;(2)把铁制成铁锅利用了铁的导热性;铁在与氧气、水共存时易发生锈蚀,所以为了防止铁锅生锈,在使用后要保持铁锅表面洁净、干燥;
(3)铁在与氧气在点燃的条件下反应生成四氧化三铁,反应方程式为3Fe+202![]() Fe3O4;铁中可能含有一定量的碳,故生成的气体可能是二氧化碳;
Fe3O4;铁中可能含有一定量的碳,故生成的气体可能是二氧化碳;
(4)铁生锈的条件是与水和氧气直接接触,要想证明铁生锈时,水一定参加了反应,就要进行铁在氧气和水共同作用下的反应实验和铁在只有氧气,没有水下的实验。实验①是铁在氧气和水共同作用下的反应,实验②是铁只与水接触下的反应,实验③是铁只与氧气接触的反应。要想证明铁生锈时,水一定参加了反应,就要进行铁在氧气和水共同作用下的反应实验和铁在只有氧气,没有水下的实验,所以应选实验①③,故选B;
(5)两种活动性不同的金属在潮湿的环境中接触时,活动性强的金属首先被腐蚀金属,由活动性顺序表可找出比铁活动性强的金属。所以,为了避免轮船的钢质外壳被腐蚀,通常在轮船外壳上镶嵌的金属是锌板。
(6)①铁锈的主要成分为Fe2O3;②实验1和2之间唯一的变量为是否有NaCl,根据含有NaCl的第2组实验,反应所需的时间较短,所以NaCl能加快铁锈蚀的速率;③通过温度升高,可以直接得出铁锈蚀的过程是放热的过程;④实验1和3是探究碳对铁锈蚀速率的影响,所以该对照组间唯一的变量应为是否含有碳,因为实验1有碳,则实验3应不含碳,其它的因素应完全相同,所以实验3的样品组成为1g铁粉、10滴水;⑤因为量筒内液体减少的体积即为广口瓶内所含有的全部氧气的体积,所以氧气的体积含量是![]() ×100%=18.7%;
×100%=18.7%;
(7)①炼铁的固体原料需经过粉碎,来增大反应接触面积,加快反应速率;②焦炭的主要成分为C,A:C+O2![]() CO2,B:CO2+C
CO2,B:CO2+C![]() 2CO;③在生铁冶炼的过程中,部分碳没有参加反应转移到的生铁中,还有部分碳生成的一氧化碳没有参加反应而损失,所以理论值小于实际用量,故选AB;
2CO;③在生铁冶炼的过程中,部分碳没有参加反应转移到的生铁中,还有部分碳生成的一氧化碳没有参加反应而损失,所以理论值小于实际用量,故选AB;
(8)由于一氧化碳和氧化铁在高温的条件下生成铁和二氧化碳,根据化学方程式进行计算代入的数据必须是纯净物的质量,可设理论上可以炼出的含铁96%的生铁的质量是x,则
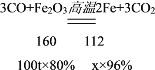
![]() ,得x=58.3t,故理论上可以炼出含铁96%的生铁的质量是58.3t。
,得x=58.3t,故理论上可以炼出含铁96%的生铁的质量是58.3t。

 阅读快车系列答案
阅读快车系列答案