题目内容
【题目】铁及其化合物在工农业生产和生活中有广泛应用.

(1)图1为高炉炼铁示意图.从炉底流出的生铁属 (填“金属单质”或“合金”).
下列作用中①与铁矿石发生反应生成铁 ②燃烧供热 ③除去铁矿石中少量杂质(如SiO2)④生成CO,属于从炉顶加入焦炭的作用有 (填字母).
A.①② B.①③ C.②③ D.②④
(2)实验室可用图2装置模拟工业炼铁并测定样品中氧化铁(Fe2O3)的质量分数(杂质不含铁元素,且不与CO反应)
【查阅资料】碱石灰能吸收二氧化碳和水蒸气
【问题讨论】装置B的作用是 ,从环保角度看该实验装置有一明显缺陷是: .
【数据处理】称取样品8.0g,用上述装置进行实验,充分反应后称量A装置增重4.4g.则 样品中氧化铁质量分数为 %.
【实验反思】当观察到反应管中固体全部变黑后,若立即停止通CO,则测得的样品中氧化铁的质量分数 (填“偏大”,“偏小”,“无影响”)
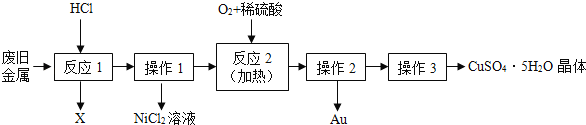
(3)废铁屑的主要成份是铁,同时还有少量铁锈(Fe2O3),用于制备动物饲料硫酸亚铁的流程如下:

①反应器中发生的反应除了Fe2O3+3H2SO4=Fe2(SO4)3+3H2O和Fe+Fe2(SO4)3=3FeSO4外,还有 ;
②滤液M的溶质有 ,操作2为 ;
③FeSO4的溶解度和析出组成如下表.在操作2中,析出FeSO47H2O晶体的最高温度不超过 ℃.
温度t/℃ | 0 | 10 | 30 | 40 | 50 | 60 | 64 | 70 | 80 | 90 |
溶解度S/g | 15.6 | 20.5 | 33.0 | 40.4 | 48.8 | 55.0 | 55.3 | 50.6 | 43.7 | 37.2 |
析出晶体 | FeSO47H2O | FeSO44H2O | FeSO4H2O | |||||||
(4)5.56g硫酸亚铁晶体(FeSO4xH2O)隔绝空气受热分解时,生成金属氧化物和气体.固体产物的质量随温度变化的曲线如图3所示.
①0~t1℃,发生的变化是加热失去结晶水,x= ;
②t2℃时B点固体组成只有一种,化学式为 .
【答案】(1)合金,D;(2)【问题讨论】吸收空气中的水和二氧化碳;未进行尾气处理;【数据处理】66.3.【实验反思】无影响;(3)①Fe+H2SO4═FeSO4+H2↑;②FeSO4、H2SO4;过滤;③60.(4)7;Fe2O3.
【解析】(1)从炉底流出的生铁是铁和碳的混合物,属于铁的合金;在高炉炼铁中碳能燃烧产生热量、能生成一氧化碳作为还原氧化铁的物质,故填:合金,D;
(2)【问题讨论】装置B中盛有的是碱石灰,碱石灰能吸收空气中的水和二氧化碳,防止对实验结果造成干扰,一氧化碳是有毒的气体,而该装置中没有进行尾气处理,故填:吸收空气中的水和二氧化碳;未进行尾气处理;
【数据处理】称取样品8.0g,用上述装置进行实验,充分反应后称量A装置增重4.4g.说明生成二氧化碳的质量为4.4g,设氧化铁的质量为x
Fe2O3+3CO![]() 2Fe+3CO2.
2Fe+3CO2.
160 132
x 4.4g
![]()
x≈5.3g
则样品中氧化铁质量分数为![]() =66.3%,故填:66.3.
=66.3%,故填:66.3.
【实验反思】当观察到反应管中固体全部变黑后,若立即停止通CO,装置A增重不变,测得的样品中氧化铁的质量分数无影响,故填:无影响;
(3)①通过分析可知,铁和硫酸反应生成了硫酸亚铁和氢气,氧化铁和硫酸反应生成了硫酸铁和水,铁与硫酸铁反应生成硫酸亚铁.故填:Fe+H2SO4═FeSO4+H2↑;
②加入的硫酸是过量的,所以在溶液中含有硫酸和反应生成的硫酸亚铁,所以滤液M中肯定含有的溶质的化学式是:FeSO4、H2SO4;操作2后得到了滤液和固体,所以可以判断操作2为过滤,故填:FeSO4、H2SO4;过滤;
③根据图表中的信息可以知道当温度大于60℃时产生了FeSO44H2O,所以应该将温度控制在60℃以下;故填:60.
(4)5.56g硫酸亚铁晶体(FeSO4xH2O)隔绝空气受热分解时,生成金属氧化物和气体.固体产物的质量随温度变化的曲线如图所示.
①0﹣t1℃,发生的变化是加热失去结晶水,
FeSO4xH2O![]() FeSO4+xH2O
FeSO4+xH2O
152+18x 152
5.56g 3.04g
![]()
x=7;
故填:7;
②硫酸亚铁分解生成金属氧化物和气体,t2℃时B点固体组成只有一种,故是氧化铁,故填:Fe2O3.

 提分百分百检测卷系列答案
提分百分百检测卷系列答案【题目】一次趣味化学活动中,王老师向同学们展示了一瓶标签受损的无色溶液,如图所示.要求同学们进行探究,确认这瓶溶液到底是什么溶液?

【提出猜想】王老师提示:这瓶无色溶液只能是下列四种溶液中的一种:
①硫酸镁溶液 ②硫酸钠溶液 ③硫酸溶液 ④硫酸铵溶液
【查阅资料】(1)常温下,相关物质的溶解度如下:
物质 | MgSO4 | Na2SO4 | (NH4)2SO4 | H2SO4 |
溶解度 | 35.1g | 19.5g | 75.4g | 与水任意比互溶 |
(2)(NH4)2SO4的水溶液显酸性
【实验探究】
(1)通过查阅资料,小明同学认为猜想 (填序号)不成立,原因是 .
(2)为确定其他几种猜想是否正确,小明同学继续进行探究:
实验操作 | 实验现象 | 实验结论 |
①取该溶液少许于试管中,向其中滴加几滴 溶液 | 溶液中有白色沉淀生成 | 猜想①成立 |
②用玻璃棒蘸取少许原溶液滴在pH试纸上,并跟标准比色卡对照 | 溶液pH 7 (填大于或小于或等于) | 猜想③成立 |
小雅同学认为小明实验操作②的结论不正确,她的理由是 ;
(3)请你设计实验方案,确认该溶液是硫酸铵溶液并完成实验报告:
实验操作 | 实验现象 | 实验结论 |
取该溶液少许于试管中, | 猜想④成立,该反应的化学方程式为 |