题目内容
【题目】请根据如图实验装置图回答问题.
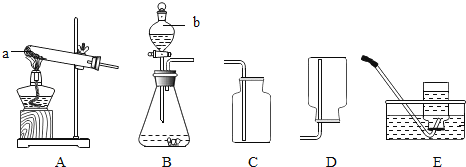
(1)写出仪器a、b的名称,a是 ,b是 .
(2)若用B装置制取氧气,反应的化学方程式是 .
(3)实验室用加热氯化铵和氢氧化钙固体混合物的方法制取氨气(NH3),应选用的发生装置为 (填装置编号).
(4)收集氨气时应选用D装置,把收集满氨气的集气瓶倒扣在滴有无色酚酞试液的水槽中,观察到集气瓶内有大量红色液体进入.根据上述信息总结出氨气的性质有 和 (回答两条即可).
【答案】(1)试管;分液漏斗;(2)2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
(3)A;(4)易溶于水;密度比空气小等.
【解析】(1)图中a是试管,b是分液漏斗;故填:试管;分液漏斗;
(2)B装置适用于固体和液体的不加热反应,制取氧气是用固态的二氧化锰作催化剂,用液态的过氧化氢分解来制取;故填:2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
(3)制得氨气是用加热氯化铵和氢氧化钙固体混合物的方法,属于“固体加热型”,所以选择A;故填:A;
(4)收集氨气时应选用D装置,说明氨气的密度小于空气的密度;氨水显碱性,碱性溶液可使酚酞试液变红,集气瓶内有大量红色液体进入,说明氨气极易溶于水形成氨水;故填:易溶于水;密度比空气小等.

【题目】铁及其化合物在工农业生产和生活中有广泛应用.

(1)图1为高炉炼铁示意图.从炉底流出的生铁属 (填“金属单质”或“合金”).
下列作用中①与铁矿石发生反应生成铁 ②燃烧供热 ③除去铁矿石中少量杂质(如SiO2)④生成CO,属于从炉顶加入焦炭的作用有 (填字母).
A.①② B.①③ C.②③ D.②④
(2)实验室可用图2装置模拟工业炼铁并测定样品中氧化铁(Fe2O3)的质量分数(杂质不含铁元素,且不与CO反应)
【查阅资料】碱石灰能吸收二氧化碳和水蒸气
【问题讨论】装置B的作用是 ,从环保角度看该实验装置有一明显缺陷是: .
【数据处理】称取样品8.0g,用上述装置进行实验,充分反应后称量A装置增重4.4g.则 样品中氧化铁质量分数为 %.
【实验反思】当观察到反应管中固体全部变黑后,若立即停止通CO,则测得的样品中氧化铁的质量分数 (填“偏大”,“偏小”,“无影响”)
(3)废铁屑的主要成份是铁,同时还有少量铁锈(Fe2O3),用于制备动物饲料硫酸亚铁的流程如下:

①反应器中发生的反应除了Fe2O3+3H2SO4=Fe2(SO4)3+3H2O和Fe+Fe2(SO4)3=3FeSO4外,还有 ;
②滤液M的溶质有 ,操作2为 ;
③FeSO4的溶解度和析出组成如下表.在操作2中,析出FeSO47H2O晶体的最高温度不超过 ℃.
温度t/℃ | 0 | 10 | 30 | 40 | 50 | 60 | 64 | 70 | 80 | 90 |
溶解度S/g | 15.6 | 20.5 | 33.0 | 40.4 | 48.8 | 55.0 | 55.3 | 50.6 | 43.7 | 37.2 |
析出晶体 | FeSO47H2O | FeSO44H2O | FeSO4H2O | |||||||
(4)5.56g硫酸亚铁晶体(FeSO4xH2O)隔绝空气受热分解时,生成金属氧化物和气体.固体产物的质量随温度变化的曲线如图3所示.
①0~t1℃,发生的变化是加热失去结晶水,x= ;
②t2℃时B点固体组成只有一种,化学式为 .
