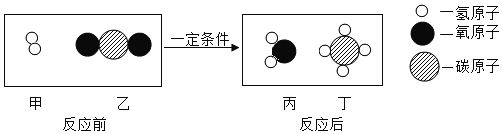
题目内容
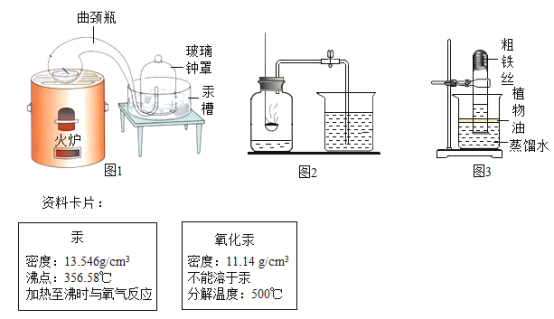
【题目】用下图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管(包括氧化铜)的质量差和U型管(包括碱石灰)的质量差,计算得氢元素和氧元素的质量比大于1﹕8.下列对导致这一结果的原因的分析中合理的是( )
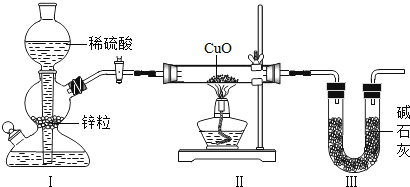
A.I、Ⅱ装置之间缺少干燥装置
B.III装置干燥剂量不足,水没有被完全吸收
C.CuO没有全部被还原
D.Ⅱ装置中玻璃管内有水冷凝
【答案】AD
【解析】
m(H):m(O)>1:8,有两种可能,①H的质量增大;②O的质量减小;通过实验图,还有一点要明白,氢元素的质量是干燥管中的质量变化减去装置II的质量变化。氧元素的质量为装置II的质量变化。
A、如果I和II之间少干燥,那么就会有部分启普发生器中的水分进入干燥U形管,那么测得的H2O就会变多,而在横向玻璃管中测得的O的质量是不会改变的,所以用H2O的质量减去O的质量就是H的质量,那么H的质量就要变大,符合题意;
B、III装置干燥剂量不足,就会使得水蒸气未被碱石灰全部吸收,使得水的质量偏小,而在横向玻璃管中测得的O元素的质量是不会改变的,所以H元素的质量就要小,mH:mO偏小,不符合题意;
C、CuO没有全部被还原,说明氢气完全反应,实验结果准确,不符合题意;
D、II中有H2O冷却的话,那么就会使玻璃管的前后质量差减小,也就是测得的O的质量较实际要小,所以相应的H就要变多,符合题意。故选AD。

练习册系列答案
 ABC考王全优卷系列答案
ABC考王全优卷系列答案
相关题目