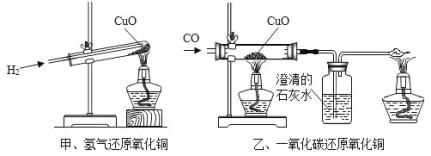
题目内容
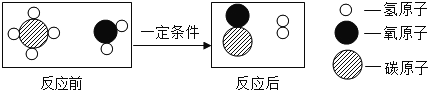
【题目】A~F是初中化学常见的物质,A、D是固体,且D是单质, B、E在通常状况下是气体,F是大理石的主要成分, 它们的转化关系如图所示,部分反应物、生成物和反应条件未标出。请回答下列问题:
(1)D的化学式为____________。
(2)反应③是自然界中重要的反应,叫________________。
(3)反应①的化学方程式是___________________,该反应的基本反应类型为__________。
(4)反应④的化学方程式为_________________,反应⑤的化学方程式为_______________。
(5)写出E的一种用途____________________。

【答案】C 光合作用 2KClO3![]() 2KCl + 3O2↑ 分解反应 CaCO3+2HCl=CaCl2+CO2↑+H2O CO2+Ca(OH)2=CaCO3↓+H2O 灭火、作制冷剂、进行人工降雨
2KCl + 3O2↑ 分解反应 CaCO3+2HCl=CaCl2+CO2↑+H2O CO2+Ca(OH)2=CaCO3↓+H2O 灭火、作制冷剂、进行人工降雨
【解析】
A是固体,在二氧化锰作催化剂的条件下能发生分解反应,则A是KClO3,2KClO3![]() 2KCl + 3O2↑,B在通常状况下是气体,则B是O2。D是单质,B与D在点燃条件下发生反应生成E,E在通常状况下是气体,E→F,F是大理石的主要成分,则F是CaCO3,E是CO2,D是C。
2KCl + 3O2↑,B在通常状况下是气体,则B是O2。D是单质,B与D在点燃条件下发生反应生成E,E在通常状况下是气体,E→F,F是大理石的主要成分,则F是CaCO3,E是CO2,D是C。
(1)D的化学式为C。
(2)二氧化碳与水在叶绿素存在,光照的条件下,发生反应生成氧气,此反应叫光合作用。
(3)反应①的化学方程式是2KClO3![]() 2KCl + 3O2↑,由一种物质发生化学反应生成两种或两种以上物质的反应是分解反应。
2KCl + 3O2↑,由一种物质发生化学反应生成两种或两种以上物质的反应是分解反应。
(4)反应④的化学方程式为CaCO3+2HCl=CaCl2+CO2↑+H2O,反应⑤的化学方程式为CO2+Ca(OH)2==CaCO3↓+H2O。
(5)CO2可用来灭火、作制冷剂、进行人工降雨。

 阅读快车系列答案
阅读快车系列答案【题目】化学兴趣小组为测定一批石灰石样品中碳酸钙的质量分数,取用20 g石灰石样品,进行高温煅烧(样品除碳酸钙外,其余成分高温不分解。碳酸钙高温分解的化学方程式为CaCO3![]()
![]() CaO+CO2↑),测得石灰石煅烧过程中的不同时段剩余固体质量如下表所示:
CaO+CO2↑),测得石灰石煅烧过程中的不同时段剩余固体质量如下表所示:
煅烧的时间(min) | 剩余固体的质量(g) |
2 | 17.8 |
4 | 13.4 |
6 | 12.3 |
8 | 12.3 |
(1)完全反应后生成二氧化碳的质量______g。
(2)求石灰石样品中碳酸钙的质量分数______。