��Ŀ����
����Ŀ��������;�㷺����ṹ�����ʵ��ǻ�ѧ����Ҫ�о����ݡ�
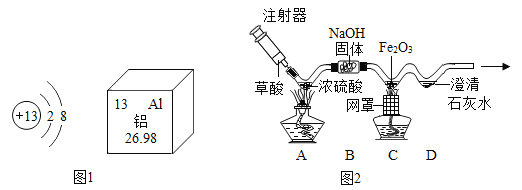
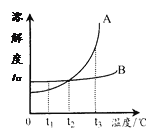
��1����ͼ1ΪԪ�����ڱ��е�һ������˵������ȷ����___��
A ����ԭ������Ϊ13
B ��ԭ�ӵĺ��������Ϊ13
C ��Ԫ�ص����ԭ������Ϊ26.98
D ��Ԫ��λ��Ԫ�����ڱ��ڶ��������ұ�
��2����������������ͭ�Ļ����Һ�м���һ�����������ۣ���ַ�Ӧ����ˡ�
�ٷ�Ӧǰ����Ƚϣ�������Һ������___��������������������������������
���������м���ϡ���ᣬ�����ݲ��������Ͳ�˵��������һ�����еĽ�����___��
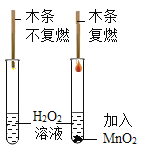
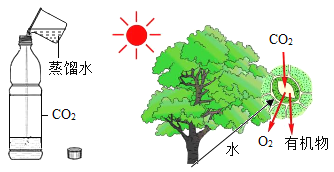
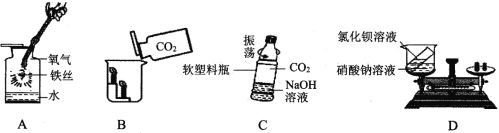
��3����ͼ2��ʵ��װ�ÿ�������ȡCOģ�ҵ��������������������ʾ�����ᣨH2C2O4����Ũ������ڲ����ȵ������£��ɷֽ�����һ����̼��������̼��ˮ����
��д��C�з�����Ӧ�Ļ�ѧ����ʽ��_____
��D�й۲쵽��ʵ��������ʲô��_______
�۴ӻ����Ƕȿ��ǣ��Ը�װ�õĸĽ���ʩ��ʲô_______
�������ʵ�鷽��֤����ʵ����������B�Ѿ�ȫ��ʧЧ��_________
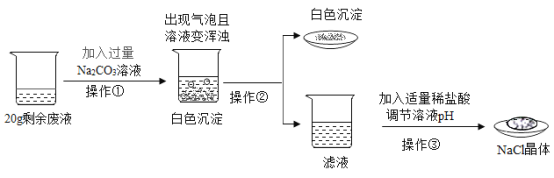
��4����ʢ��9g�������ձ��е���100gϡ���ᣬǡ����ȫ��Ӧ������ձ���ʣ�����ʵ�������Ϊ108.8g����������ϡ���������ʵ�����������_________
���𰸡�D ���� �ڽ������˳���У�������ͭ������ǰ�ߣ����Ժ�������������ͭ��Һ��Ӧ����������ͭ�Լ������������������м���������ϡ���ᣬ�����ݲ�����˵��������һ��������һ��������ͭ Fe2O3+3CO![]() 2Fe+3CO2 ����ʯ��ˮ����ǣ� ��װ�õ����Ҷ˷�һȼ�ŵľƾ��� ȡ�����Ĺ���B��һ�ɾ����Թ��м���һ������ˮ�ܽ�õ���Һ�������������Ȼ�����Һ����һ�ᣬ�����ϲ���Һ�еμ���ɫ��̪��Һ����Һ�ޱ仯��˵����ʵ����������B�Ѿ�ȫ��ʧЧ 9.8%
2Fe+3CO2 ����ʯ��ˮ����ǣ� ��װ�õ����Ҷ˷�һȼ�ŵľƾ��� ȡ�����Ĺ���B��һ�ɾ����Թ��м���һ������ˮ�ܽ�õ���Һ�������������Ȼ�����Һ����һ�ᣬ�����ϲ���Һ�еμ���ɫ��̪��Һ����Һ�ޱ仯��˵����ʵ����������B�Ѿ�ȫ��ʧЧ 9.8%
��������
��1������ͼ1��Ϣ��Ԫ���������ϽDZ�ʾ����ԭ�����������·���ʾ�������ԭ�������� A������ԭ������Ϊ13��ѡ��A��ȷ��
B����Ϊԭ���У�ԭ�����������������������������������ԭ������Ϊ13��������ԭ�ӵĺ��������Ϊ13��ѡ��B��ȷ��
C����Ԫ�ص����ԭ������Ϊ26.98��ѡ��C��ȷ��
D����ԭ�Ӻ������������Ӳ㣬�ǵ�������Ԫ�أ�ѡ��D����ѡD��
��2�����ڽ����˳���У�����ͭ������ǰ�棬������������ͭ�������۷�Ӧ����ѧ����ʽΪΪ��2AgNO3+Fe��Fe(NO3)2+2Ag��Fe+ Cu(NO3)2��Fe(NO3)2+Cu�����ݻ�ѧ����ʽ��֪��ÿ56�����������û���ȥ216������������ÿ56�����������û���64��������ͭ���ʷ�Ӧǰ����Ƚϣ�������Һ���������٣�
���������֪���ڽ������˳���У�������ͭ������ǰ�ߣ����Ժ�������������ͭ��Һ��Ӧ����������ͭ�Լ������������������м���������ϡ���ᣬ�����ݲ�����˵��������һ������ʣ�ࡢҲһ��������ͭ���������к�����������ͭ��
��3����һ����̼���������ڸ��µ������������Ͷ�����̼����ѧ����ʽΪ��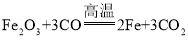 ��
��
�ڶ�����̼���������Ʒ�Ӧ���ɰ�ɫ����̼��ƺ�ˮ�����������ǣ�����ʯ��ˮ����ǣ�
����Ϊһ����̼�ж�������ֱ���ŷŵ��������Է���Ⱦ������Ҫ��װ�õ����Ҷ˷�һȼ�ŵľƾ��ƣ�
����Ϊ�Ȼ��ƺ�̼���Ʒ�Ӧ����������ˮ��̼��ƺ����Ե��Ȼ�����Һ���������������ȫ�����ʣ���B�����ʸ��������Ȼ��Ʒ�Ӧ����ҺΪ���ԣ�������ֱ��ʣ���̼����ȫ����Ӧ����Һ�л����������ƣ���Һ�ͳʼ��ԡ����֤����ʵ����������B�Ѿ�ȫ��ʧЧ�ķ����ǣ�ȡ�����Ĺ���B��һ�ɾ����Թ��м���һ������ˮ�ܽ�õ���Һ�������������Ȼ�����Һ������һ�ᣬ�����ϲ���Һ�еμ���ɫ��̪��Һ����Һ�ޱ仯��˵����ʵ����������B�Ѿ�ȫ��ʧЧ��
��4�����������غ㶨�ɣ���������������Ϊ�� 9g+100g��108.8g��0.2g
������0.2g������ҪH2SO4������Ϊx��
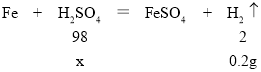
![]()
���x��9.8g
����ϡ���������ʵ���������Ϊ��![]() =9.8%
=9.8%
������ϡ���������ʵ���������Ϊ 9.8%��

����Ŀ�������Ȼ��ƺ�����ص��ܽ�ȱ����ش��������⣺
�¶ȣ��棩 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
�Ȼ����ܽ�ȣ��ˣ� | 35.8 | 36.0 | 36.3 | 36.4 | 37.0 | 37.3 | 37.8 |
������ܽ�ȣ��ˣ� | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 |
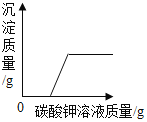
��1��д������غ��Ȼ��ƾ���ͬ�ܽ��ʱ���¶ȷ�Χ���ޱ������������¶�֮�䣩_____��
��2��50�棬��100��ˮ�м���90������أ���ֽ����������Һ����Ϊ_____��
��3������20��ʱ�Ȼ��Ʊ�����Һ��������������_____����д��������̣�